修回日期: 2013-08-20
接受日期: 2013-08-29
在线出版日期: 2013-10-18
目的: 观察活血化瘀通络中药合方及拆方对糖尿病大鼠脂肪肝及细胞因子信号转导抑制物-3(suppressors of cytokine signaling protein-3, SOCS-3)mRNA和类固醇条件元件结合蛋白-1c(sterol regulatory element binding protein-1c, SREBP-1c)mRNA表达的影响, 探讨其抗糖尿病性脂肪肝的作用及可能机制.
方法: 将50只健康♂SD大鼠随机分为正常组、模型组、中药1组(活血组, 丹参、川芎)、中药2组(通络组, 水蛭、地龙)和中药3组(合方组, 水蛭、地龙、丹参、川芎), 除正常组外, 参照相关文献复制糖尿病性脂肪肝大鼠模型, 造模成功后, 正常组和模型组予生理盐水灌胃, 中药1、2、3 组分别予活血中药(丹参、川芎), 通络中药(水蛭、地龙), 合方中药(水蛭、地龙、丹参、川芎)灌胃, 1次/d; 12 wk后处死大鼠, 生化法测量甘油三脂(triglyceride, TG)、胆固醇(cholesterol, TC), RT-PCR法检测肝组织SOCS-3 mRNA和SREBP-1c mRNA的表达.
结果: 与正常组相比, 模型组及各药物干预组大鼠血清TC、TG水平明显升高(6.80 mmol/L±0.19 mmol/L, 5.36 mmol/L±0.24 mmol/L, 5.37 mmol/L±0.25 mmol/L, 5.01 mmol/L±0.22 mmol/L vs 3.55 mmol/L±0.28 mmol/L, P<0.05)、(2.26 mmol/L±0.27 mmol/L, 1.83 mmol/L±0.25 mmol/L, 1.82 mmol/L±0.23 mmol/L, 1.58 mmol/L±0.19 mmol/L vs 1.35 mmol/L±0.16 mmol/L, P<0.05); 与模型组相比, 各药物干预组大鼠血清TC、TG水平有明显降低(5.36 mmol/L±0.24 mmol/L, 5.37 mmol/L±0.25 mmol/L, 5.01 mmol/L±0.22 mmol/L vs 6.80 mmol/L±0.19 mmol/L, P<0.05)、(1.83 mmol/L±0.25 mmol/L, 1.82 mmol/L±0.23 mmol/L, 1.58 mmol/L±0.19 mmol/L vs 2.21 mmol/L±0.21 mmol/L, P<0.05); 中药各组间比较: 中药3组TC、TG水平比中药1、2组低(5.01 mmol/L±0.22mmol/L vs 5.36 mmol/L±0.24 mmol/L, 5.37 mmol/L±0.25 mmol/L, P<0.05)、(1.58 mmol/L±0.19 mmol/L vs 1.83 mmol/L±0.25 mmol/L, 1.82 mmol/L±0.23 mmol/L, P<0.05); 中药2组的TC、TG水平比中药1组低, 但没有统计学意义. 各药物干预组大鼠肝细胞内脂肪滴减少, 脂肪囊肿消失, 转为轻中度脂肪变性, 脂肪变较模型组明显减轻; 合方组较拆方组脂肪变减轻; 与正常组相比, 模型组和各药物干预组SOCS-3和SREBP-1c表达均增强(0.885±0.227, 0.778±0.005, 0.633±0.678, 0.475±0.012 vs 0.189±0.002, P<0.05)、(0.861±0.020, 0.751±0.003, 0.600±0.005, 0.382±0.014 vs 0.176±0.001, P<0.05); 与模型组相比, 各药物干预组SOCS-3和SREBP-1c表达均减弱(0.778±0.005, 0.633±0.678, 0.475±0.012 vs 0.885±0.227, P<0.05)、(0.751±0.003, 0.600±0.005, 0.382±0.014 vs 0.861±0.020, P<0.05); 与中药3组相比, 中药1、2组 SOCS-3和SREBP-1c表达均升高(0.751±0.003, 0.600±0.005 vs 0.382±0.014, P<0.05)、(0.778±0.005, 0.633±0.678 vs 0.475±0.012 , P<0.05); 相关分析显示, SOCS-3 mRNA和SREBP-1c mRNA呈正相关(r = 0.978, P<0.05).
结论: 活血化瘀通络中药合方及拆方可以明显改善糖尿病脂肪肝, 其作用机制可能与降低SOCS-3和SREBP-1c的表达有关; 合方组明显优于拆方组.
核心提示: 活血化瘀通络中药能显著改善脂肪变性, 降低细胞因子信号转导抑制物-3(suppressors of cytokine signaling protein-3, SOCS-3)mRNA和类固醇条件元件结合蛋白-1c(sterol regulatory element binding protein-1c, SREBP-1c)mRNA的表达, 提示活血化瘀通络中药可明显改善改善糖尿病性脂肪肝大鼠的脂肪变性, 其机制可能与其下调SOCS-3和SREBP-1c mRNA表达有关, 且活血中药和通络中药具有协同作用.
引文著录: 朱雅娜, 孙玉凤, 何莉莉, 任荣, 张玉, 王飞, 李风华, 张艺凡, 郭沛然. 活血化瘀通络中药合方及拆方对糖尿病脂肪肝大鼠SOCS-3和SREBP-1c的影响. 世界华人消化杂志 2013; 21(29): 3089-3096
Revised: August 20, 2013
Accepted: August 29, 2013
Published online: October 18, 2013
AIM: To investigate the effect of promoting blood circulation and removing blood stasis traditional Chinese medicine on the expression of suppressors of cytokine signaling protein-3 (SOCS-3) and sterol regulatory element binding protein-1c (SREBP-1c) in diabetic fatty liver in rats and to explore potential mechanisms involved.
METHODS: Fifty healthy male Sprague-Dawley rats were randomly divided into five groups: a normal group, a model group, a promoting blood circulation group (salvia miltiorrhiza, rhizoma ligustici, wallichii), a removing blood stasis group (leech, lumbricus), and a combination group (salvia miltiorrhiza, rhizoma ligustici, wallichii, leech, lumbricus). Diabetes was induced with streptozocin (50 mg/kg i.p.) in all the groups except for the normal group. The three treatment groups were intragastrically treated with Chinese traditional medicine which can promote blood circulate and/or remove stasis once a day for 12 wk. Triglyceride (TG) and cholesterol (TC) were measured using biochemical methods. The expression of SOCS-3 and SREBP-1c mRNAs was determined by RT-PCR.
RESULTS: Compared to the normal group, the levels of TG and TC were significantly increased in the model group (6.80 mmol/L ± 0.19 mmol/L, 5.36 mmol/L ± 0.24 mmol/L, 5.37 mmol/L ± 0.25 mmol/L, 5.01 mmol/L ± 0.22 mmol/L vs 3.55 mmol/L ± 0.28 mmol/L, all P < 0.05; 2.26 mmol/ ± 0.27 mmol/L, 1.83 mmol/L ± 0.25 mmol/L, 1.82 mmol/L ± 0.23 mmol/L, 1.58 mmol/L ± 0.19 mmol/L vs 1.35 mmol/L ± 0.16 mmol/L, all P < 0.05); however, the levels of TG and TC were significantly lower in each drug intervention group than in the model group (5.36 mmol/L ± 0.24 mmol/L, 5.37 mmol/L ± 0.25 mmol/L, 5.01 mmol/L ± 0.22 mmol/L vs 6.80 mmol/L ± 0.19 mmol/L, all P < 0.05; 1.83 mmol/L ± 0.25mmol/L, 1.82 mmol/L ± 0.23 mmol/L, 1.58 mmol/L ± 0.19 mmol/L vs 2.21 mmol/L ± 0.21 mmol/L, all P < 0.05). The levels of TG and TC were significantly higher in the promoting blood circulation group and removing blood stasis group than in the combination group (5.01 mmol/L ± 0.22 mmol/L vs 5.36 mmol/L ± 0.24 mmol/L, 5.37 mmol/L ± 0.25 mmol/L, both P < 0.05; 1.58 mmol/L ± 0.19 mmol/L vs 1.83 mmol/L ± 0.25 mmol/L, 1.82 mmol/L ± 0.23 mmol/L, both P < 0.05). There was no significant change in the levels of TG and TC between the promoting blood circulation group and removing blood stasis group. Compared to the model group, liver steatosis was significantly reduced in each drug intervention group; however, liver steatosis was significantly more serious in the promoting blood circulation group and removing blood stasis group than in the combination group. Compared to the normal group, the expression of SOCS-3 and SREBP-1c mRNAs was significantly increased in the model group (0.885 ± 0.227, 0.778 ± 0.005, 0.633 ± 0.678, 0.475 ± 0.012 vs 0.189 ± 0.002, all P < 0.05; 0.861 ± 0.020, 0.751 ± 0.003, 0.600 ± 0.005, 0.382 ± 0.014 vs 0.176 ± 0.001, all P < 0.05). However, the expression of SOCS-3 and SREBP-1c mRNAs was significantly lower in each drug intervention group than in the model group (0.778 ± 0.005, 0.633 ± 0.678, 0.475 ± 0.012 vs 0.885 ± 0.227, both P < 0.05; 0.751 ± 0.003, 0.600 ± 0.005, 0.382 ± 0.014 vs 0.861 ± 0.020, both P < 0.05). The expression of SOCS-3 and SREBP-1c mRNAs was significantly higher in the promoting blood circulation group and removing blood stasis group than in the combination group (0.751 ± 0.003, 0.600 ± 0.005 vs 0.382 ± 0.014, both P < 0.05; 0.778 ± 0.005, 0.633 ± 0.678 vs 0.475 ± 0.012, both P < 0.05).
CONCLUSION: Both combined prescription and separate prescription of promoting blood circulation and removing blood stasis traditional Chinese medicine can alleviate fatty liver in rats possibly by decreasing the expression of SOCS-3 and SREBP-1c mRNAs. Combined prescription is better than separate prescription in alleviating fatty liver.
- Citation: Zhu YN, Sun YF, He LL, Ren R, Zhang Y, Wang F, Li FH, Zhang YF, Guo PR. Effect of combined prescription and separate prescription of promoting blood circulation and removing blood stasis traditional Chinese medicine on expression of SOCS-3 and SREBP-1c in diabetic fatty liver in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3089-3096
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3089.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3089
糖尿病性脂肪肝是指由于胰岛素分泌不足或相对缺乏引发的肝脏的脂代谢紊乱. 正常成人在一般膳食条件下, 肝脏脂肪含量约占肝脏湿重的3%-5%, 糖尿病时由于脂肪代谢障碍, 使肝脏脂肪含量增加, 当肝脏脂肪含量超过肝脏重量10%时, 谓之糖尿病性脂肪肝[1]. 糖尿病脂肪肝包含于非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD), 其发病机制与NAFLD相同. NAFLD是指由酒精和其他明确的肝损伤因素之外的原因所致, 以肝细胞脂肪变性和脂肪沉积为特征的临床病理综合征, 按病理学分类可分为单纯性非酒精性脂肪肝、非酒精性脂肪性肝炎和非酒精性脂肪性肝硬化[2]. 其常与肥胖、2型糖尿病、血脂紊乱同时存在, 被视为代谢综合征的肝脏表现[3]. NAFLD发生与胰岛素抵抗(insulin resistance, IR)密切相关, 改善IR对NAFLD有一定的治疗作用. 近年来研究发现细胞因子信号转导抑制物-3(suppressors of cytokine signaling protein-3, SOCS-3)在IR和NAFLD 的发生发展中起到非常重要的作用[4]. SOCS-3一方面通过抑制胰岛素信号传导, 引起胰岛素抵抗, 导致NAFLD; 另一方面通过上调肝脏类固醇条件元件结合蛋白-1c(sterol regulatory element binding protein-1c, SREBP-1c)促进脂肪酸合成, 导致NAFLD. 由于生活水平的提高和不合理饮食, 糖尿病性脂肪肝患者逐年增加, 活血化瘀通络中药临床广泛应用于糖尿病性脂肪肝患者, 并取得了一定疗效. 本实验建立糖尿病脂肪肝大鼠模型, 应用活血化瘀通络中药进行干预, 观察活血化瘀通络中药合方及拆方对糖尿病性脂肪肝的作用及对SOCS-3和SREBP-1c的影响.
6-8周龄清洁级♂SD大鼠50只, 体质量为200-210 g, 由河北医科大学动物实验室提供, 许可证编号: 1112061, 分笼饲养, 每笼4只, 室温19 ℃-24 ℃, 湿度60%-70%, 自由饮水饮食, 明暗周期12 h/12 h. 高热量饲料由基础饲料、炼猪油、胆固醇粉、胆酸钠粉按87.5%、10.0%、2.0%、0.5%的比例混合而成[5]. 适应性喂养1 wk后, 按体质量随机分为6组, 每组10只: 正常组、模型组、中药1组活血组、中药2组(通络组)、中药3组(合方组). 引物序列由NCBI-Nucleotide基因库检索, Primer5.0软件设计, 华瑞创新生物科技开发中心合成. SOCS-3 mRNA引物: 上游引物5'-GCT CCA AGA GCG AGT ACC AG-3'; 下游引物: 5'-AGT ACA CAG TCA AAG CGG GG-3', 扩增片段为286 bp. SREBP-1c mRNA引物: 上游引物: 5'-GCC ATG GAT TGC ACA TTT GAA GAC-3'; 下游引物: 5'-GAG GGA AGC TCG GAG GCA AC-3', 扩增片段为379 bp. 内参甘油醛-3-磷酸脱氢酶(GAPDH) mRNA引物: 上游引物: 5'-CCT TCA TTG ACC TCA ACT AC-3'; 下游引物: 5'-GGA AGG CCA TGC CAG TGA GC-3', 扩增片段为594 bp.
1.2.1 造模及给药: 除正常组外, 其余尾静脉注射链脲佐菌素(STZ)25 mg/kg, 临用前STZ按1%比例以柠檬酸缓冲液(pH 4, 0.1 mmol/L)稀释. 于注射后72 h及1 wk时, 尾静脉采血, 若随机血糖≥16.7 mmol/L, 确定为糖尿病造模成功. 用基础饲料喂养2 wk后, 除正常组外, 改为高脂饲料喂养. 中药购于河北省中医院中药房, 剂型为袋装免煎剂, 根据大鼠体质量称取相应中药1.2 g/(kg·d), 用2 mL的沸水冲泡, 凉至35 ℃左右灌胃; 正常组和模型组灌服等量生理盐水; 所有动物均于每天上午灌胃1次, 连续给药l2 wk. 实验完全结束, 禁食l2-14 h, 以戊巴比妥钠(40 mg/kg)腹腔麻醉, 经腹主动脉取血10 mL, 30 min内分离血清, 置80 ℃冰箱保存备用1 wk内进行检测, 并留取大鼠肝组织备用.
1.2.2 血脂测定: 生化法检测血清学指标甘油三脂(triglyceride, TG)、胆固醇(cholesterol, TC).
1.2.3 肝组织的病理观察: 苏木素伊红(HE)染色, 光镜下观察.
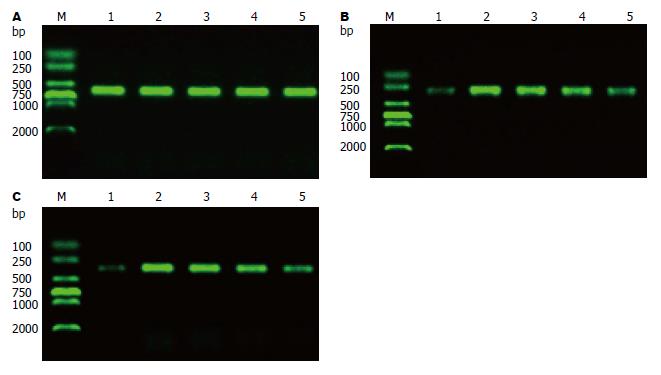
1.2.4 RT-PCR法检测SOCS-3 mRNA和SREBP-1c mRNA表达: (1)提取肝组织总RNA: 先将匀浆器插入冰中, 从-80 ℃冰箱中取组织100 mg左右, 放入匀浆器内, 然后加入1 mL TRIzol迅速研磨至无颗粒透明状然后转移至新的离心管中, 室温静置5 min, 4 ℃ 12000 r/min离心5 min, 然后小心吸取上清液于另一离心管中, 加入1/5体积的氯仿, 震荡混匀后室温静置5 min, 4 ℃ 12000 r/min离心15 min, 转移上层水相到另一新离心管中, 加入等体积的异丙醇, 充分混匀后室温静置10 min, 然后4 ℃ 12000 r/min离心10 min, RNA形成白色的小团沉淀在离心管的底部和侧面, 弃上清, 加入750 mL/L的乙醇1 mL, 4 ℃ 12000 r/min离心5 min, 尽量弃上清, 漂洗2-3次RNA沉淀, 最后在无菌工作台中干燥RNA沉淀5-10 min, 加入DEPC处理的50 µL双蒸馏水, 55 ℃-60 ℃温育10 min使RNA充分溶解, 随即使用或置于-80 ℃保存备用. 取少许溶解的RNA, 用TE Buffer稀释后于紫外分光光度计260和280 nm处读A值, A260/280 = 1.8-2.0间方可使用, 总RNA浓度 = A260×稀释倍数×0.04(µg/µL), 用前调整为1 µg/µL; (2)逆转录反应: 取总RNA 1 µg, 加入RT反应体系(含AMV Buffer, dNTPs, Oligo dT Primer, AMV, RNase Inhibitor等)于离心管中, 并用DEPC处理水补足到20 µL反应液体积, 震荡混匀后短暂离心, 加少许矿物油于PCR仪42 ℃ 30 min(cDNA合成), 99 ℃ 5 min(逆转录酶失活), 5 ℃ 5 min. -20 ℃保存备用; (3)PCR反应体系: 反应体系含Mix 10 µL, cDNA 2 µL, 上游引物 1 µL, 下游引物 1 µL, 补DEPC 处理水至20 µL, 震荡混匀后短暂离心, 加少许矿物油于PCR仪扩增. 按各自反应条件进行扩增: SOCS-3反应条件: 94 ℃预变性3 min; 94 ℃变性40 s, 55 ℃退火50 s, 72 ℃延伸90 s, 循环30次, 72 ℃延伸10 min. SREBP-1c反应条件: 94 ℃预变性3 min; 94 ℃变性40 s, 56 ℃退火50 s, 72 ℃延伸90 s, 循环30次, 72 ℃延伸10 min. GAPDH反应条件: 94 ℃预变性3 min; 94 ℃变性40 s, 59 ℃退火50 s, 72 ℃延伸90 s, 循环30次, 72 ℃延伸10 min; (4)半定量分析: PCR产物在含5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)的1%琼脂糖凝胶中电泳后, 置于凝胶分析系统(UVP公司, 美国)进行吸光度扫描, 用目的基因吸光度与内参(GAPDH)吸光度的比值来表示目的基因相对表达含量.
统计学处理 应用SPSS13.0统计分析软件进行统计分析, 数据以mean±SD表示. 多组间比较采用单因素方差分析(One way ANOVA), 进一步两两比较采用SNK法. P<0.05为差异有统计学意义.
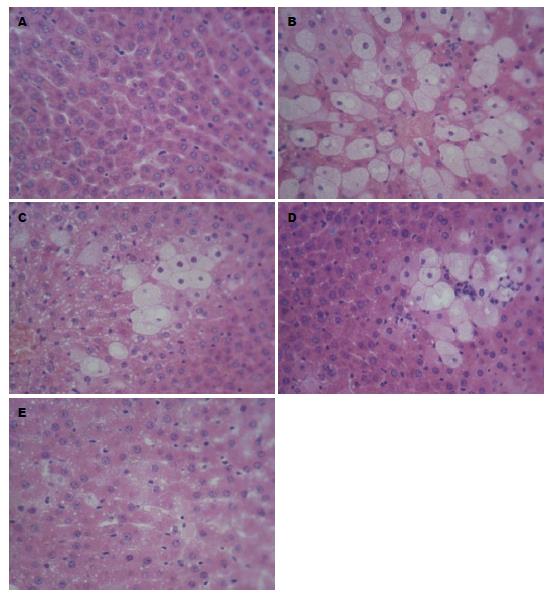
大体形态改变: 正常组大鼠肝脏外观大小形态正常, 轮廓光滑整齐, 色泽红润; 模型组大鼠肝脏外观呈弥漫性肿大, 边缘钝而厚, 表面光滑, 质如面团, 压迫时可出现凹陷, 表面色泽较苍白或带灰黄色, 切面可呈黄红或淡黄色, 有油腻感; 各药物干预组大鼠肝脏外观轻度肿大, 肉眼可见部分正常肝脏区域, 颜色为浅黄色, 油腻感减轻, 脂肪病变明显减轻.
脂肪肝的基本病理改变为肝细胞肿大, 充满大小不等的脂肪空泡(脂滴), 空泡大和多者可将肝细胞核推向一侧. 数个含有脂肪滴的肝细胞可破裂, 形成脂肪囊肿, 囊肿破裂后可引起炎症反应. 轻至中度脂肪变性在肝小叶中心区最为明显, 一般无明显的炎症反应和细胞坏死. 重度脂肪变性整个肝小叶的肝细胞都有脂肪变性, 可伴有轻度局限性炎症和单纯性坏死, 另外还可伴有一定程度的肝纤维结缔组织增生. 模型组2/3以上肝小叶的肝细胞都有脂肪变性, 有脂肪囊肿, 属于中重度脂肪变性; 各药物干预组大鼠脂肪变较模型组明显减轻; 合方组脂肪变较拆方组减轻(图1).
与正常组相比, 模型组及各药物干预组大鼠血清TC、TG水平明显升高(P<0.05); 与模型组相比, 各药物干预组大鼠血清TC、TG水平有明显降低(P<0.05); 中药各组间比较: 中药3组TG水平比中药1、2组低(P<0.05); 中药2组的TC、TG水平比中药1组低, 但没有统计学意义(P>0.05); 实验开始前, 正常组与实验组大鼠体质量没有明显差别(P>0.05); 与正常组比较, 模型组及各药物干预组体质量明显下降(P<0.05); 与模型组相比, 各药物干预组大鼠体质量明显下降(P<0.05); 中药各组间比较: 中药3组大鼠体质量较中药1、2组明显下降(P<0.05), 中药1、2组大鼠体质量没有明显差别(P>0.05); 与正常组比较, 模型组及各药物干预组大鼠血糖明显升高(P<0.05); 与模型组相比, 各药物干预组大鼠血糖明显降低(P<0.05); 中药各组间比较:中药3组大鼠血糖较中药1、2组明显下降(P<0.05), 中药1、2组大鼠血糖没有明显差别( P>0.05)(表1).
| 分组 | 体质量(g) | 血糖(mmol/L) | 甘油三脂(mmol/L) | 胆固醇(mmol/L) | |
| 实验前 | 实验后 | ||||
| 正常组 | 205.48±0.47 | 310.25±0.68 | 6.15±0.65 | 3.55±0.28 | 1.35±0.16 |
| 模型组 | 205.84±0.32 | 253.03±0.54a | 20.95±0.41a | 6.80±0.19a | 2.26±0.27a |
| 中药1组 | 205.65±0.42 | 234.79±0.93ace | 16.66±0.32ace | 5.36±0.24ace | 1.83±0.25ace |
| 中药2组 | 204.99±0.38 | 234.79±0.92ace | 16.58±0.34ace | 5.37±0.25ace | 1.82±0.23ace |
| 中药3组 | 204.96±0.46 | 233.29±0.65ac | 15.23±0.25ac | 5.01±0.22ac | 1.58±0.19ac |
与正常组相比, 模型组及各药物干预组SOCS-3和SREBP-1c表达均增强(P<0.05); 与模型组相比, 各药物干预组SOCS-3和SREBP-1c表达均减弱(P<0.05); 与中药3组相比, 中药1、2组SOCS-3和SREBP-1c表达均减弱(P<0.05); 与中药1组比较, 中药2组SOCS-3和SREBP-1c表达减弱(P<0.05). 相关分析显示, SOCS-3 mRNA和SREBP-1c mRNA呈正相关(r = 0.978, P<0.05)(图2, 表2).
随着生活水平的提高和饮食结构的改变, NAFLD已经成为现代社会最常见的肝病之一[6]. 糖尿病脂肪肝属于NAFLD的范畴. 目前, "二次打击"学说作为NAFLD的经典发病机制, 已经被广泛接受. 首次打击主要是指脂肪在肝脏实质细胞内的过度聚集, 这一过程已经被证实与胰岛素抵抗有关, 胰岛素抵抗会导致细胞内甘油三酯的合成与转运功能紊乱. 因此, 改善胰岛素抵抗对NAFLD有一定的治疗作用[7].
SOCS家族是近年发现的受细胞因子诱导的蛋白质家族. 人的SOCS-3基因与大鼠、小鼠的同源性约90%. SOCS-3广泛分布于胸腺、脑、心脏、骨骼肌、肝脏、白色脂肪、胰腺、肾脏、肺、胎盘、前列腺、外周血白细胞、卵巢、睾丸、小肠、大肠等组织器官[8]SOCS-3可通过多个环节, 抑制胰岛素信号传导, 引起胰岛素抵抗, 最终导致NAFLD的发生, 其机制主要包括以下几个方面: (1)竞争性结合胰岛素受体抑制胰岛素信号传导: SOCS-3可以竞争性结合胰岛素受体[9], 抑制了STAT5b的磷酸化及其对胰岛素受体底物蛋白(IRS)的磷酸化作用, 从而抑制了胰岛素信号的传导; (2)抑制JAK活化: SOCS-3通过与磷酸化的JAK结合, 抑制JAK的激酶活性[10], 进而抑制胰岛素诱导的JAK活化, 导致胰岛素抵抗的发生; (3)降解IRS, 进而抑制胰岛素信号传导, 导致胰岛素抵抗[11].
SOCS-3还可通过上调肝脏类固醇条件元件结合蛋白-1c(sterol regulatory element binding proteins -1c, SREBP-1c)的表达使脂肪酸合成增加及肝脏脂肪沉积, 引起NAFLD. STAT是抑制SREBP-1c启动子活性的分子, SOCS-3是JAK/STAT通路的负反馈抑制因子, SOCS-3表达的增加可下调STAT, 进而导致SREBP-1c表达的增加, 造成了脂肪在肝脏的沉积. SREBP-1c是一种核转录因子, 又称脂肪细胞定向和分化因子1, 他直接参与调控有关脂肪酸、甘油三酯合成和葡萄糖代谢相关酶基因的表达, 包括乙酰辅酶A羧化酶(acetyl CoA carboxylase, ACC)、脂肪酸合酶(fatty acid synthase, FAS)和固醇酰辅酶A脱氢酶1(SCD-1), 能激活脂肪酸合成途径中多种基因转录子, 启动合成程序, 从而使肝脏脂质尤其是甘油三酯含量增加, 从而导致肝脏脂肪变性[12]. 曾有研究[13]表明利用反义寡核苷酸的方法可以明显的降低SREBP-1c的表达, 同样地, 由SREBP-1c直接转录的脂肪酸合成酶ACC、FAS和SCD-1也明显的降低. 还有一项研究利用基因重组技术产生缺乏SREBP-1c编码基因的小鼠, 并且发现这类突变小鼠肝脏中脂肪酸的合成明显下降[14], 这些研究表明降低SREBP-1c的表达, 可以改善肝脏脂肪变性. SREBP-1c表达增加导致游离脂肪酸(free fatty acid, FFA)的合成增多[15]. FFA可抑制外周葡萄糖的利用及氧化, 抑制合成肌糖原, 使血糖升高; FFA又促进糖异生, 诱发高胰岛素血症[16], 脂肪细胞接受升高的胰岛素信号后, 加强对脂肪的分解, 大量的FFA被转运到肝细胞中, 在高胰岛素血症刺激下大量合成脂肪酸, 导致肝脏脂质沉积, 而脂质的异位沉积可加重胰岛素抵抗, 形成恶性循环[17].
脂肪肝相当于中医学中的"积聚"与"痰痞", 其基本病机为嗜食肥甘厚味, 滋生痰浊, 痰湿阻滞, 导致气机郁滞, 血脉瘀阻, 气、血、痰、浊互相搏结, 聚滞为积, 阻于肝络, 发为本病, 故临床上多采用活血化瘀通络的治疗方法, 并取得良好疗效.
本实验采用高脂高胆固醇饲料加小剂量STZ制备糖尿病性脂肪肝大鼠模型, 应用活血化瘀通络中药的拆方与合方治疗糖尿病脂肪肝大鼠, 观察活血化瘀通络中药对脂肪肝的作用和对SOCS-3和SREBP-1c表达的影响, 并将活血中药、通络中药及合方中药进行比较, 以探讨其疗效及可能机制. 结果显示: 活血化瘀通络中药能显著改善脂肪变性, 降低SOCS-3 mRNA和SREBP-1c mRNA的表达, 合方明显优于拆方组, 通络组疗效优于活血组, 提示活血化瘀通络中药可明显改善改善糖尿病性脂肪肝大鼠的脂肪变性, 其机制可能与其下调SOCS-3和SREBP-1c mRNA表达有关, 且活血中药和通络中药具有协同作用.
糖尿病脂肪肝为糖尿病患者的常见并发症, 其缘于糖尿病脂质代谢障碍, 造成脂肪在肝脏的过多沉积. 随着生活水平的提高和饮食结构的改变, 糖尿病脂肪肝患者逐年增加, 如果得不到及时治疗, 很可能进一步恶化, 发展为肝硬化, 甚至肝癌. 活血化瘀通络中药广泛应用于临床糖尿病脂肪肝患者, 并且取得一定疗效, 但有关其作用机制, 国内外未见相关报道.
郝丽萍, 副教授, 华中科技大学同济医学院公共卫生学院营养与食品卫生学系
近年来研究较多的肝细胞材料为猪肝细胞和肿瘤源性肝细胞株(C3A、HepG2等), 但动物肝细胞存在发生免疫反应及传播动物源性病毒的危险, 肿瘤源性肝细胞株分化程度低、生物学功能低下且在临床应用中存在细胞逃逸进入患者体内引起肿瘤的危险, 限制了临床的广泛应用.
Bloomgarden研究发现近年来研究发现细胞因子信号转导抑制物-3(suppressors of cytokine signaling protein-3, SOCS-3)在IR和非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)的发生发展中起到非常重要的作用. SOCS-3一方面通过抑制胰岛素信号传导, 引起胰岛素抵抗, 导致NAFLD; 另一方面通过上调肝脏类固醇条件元件结合蛋白-1c(sterol regulatory element binding protein-1c, SREBP-1c)促进脂肪酸合成, 导致NAFLD.
本文从活血化瘀通络中药下调SOCS-3和SREBP-1c mRNA的表达, 来探讨活血化瘀通络中药治疗糖尿病脂肪肝可能作用机制.
本文从活血化瘀通络中药改善糖尿病脂肪肝方面, 为临床治疗糖尿病脂肪肝提供新的思路.
本文为中药在临床上更好应用及药理研究提供基础和依据, 有一定的意义.
编辑:田滢 电编:鲁亚静
| 2. | Brunt EM, Tiniakos DG. Histopathology of nonalcoholic fatty liver disease. World J Gastroenterol. 2010;16:5286-5296. [PubMed] [DOI] |
| 3. | 唐 启盛. 抑郁症-中西医基础与临床. 北京: 中国中医药出版社 2006; 217-227. |
| 4. | Bloomgarden ZT. Second World Congress on the Insulin Resistance Syndrome: insulin resistance syndrome and nonalcoholic fatty liver disease. Diabetes Care. 2005;28:1518-1523. [PubMed] [DOI] |
| 6. | Erickson SK. Nonalcoholic fatty liver disease. J Lipid Res. 2009;50 Suppl:S412-S416. [PubMed] [DOI] |
| 7. | Krawczyk M, Bonfrate L, Portincasa P. Nonalcoholic fatty liver disease. Best Pract Res Clin Gastroenterol. 2010;24:695-708. [PubMed] [DOI] |
| 8. | Dey BR, Furlanetto RW, Nissley P. Suppressor of cytokine signaling (SOCS)-3 protein interacts with the insulin-like growth factor-I receptor. Biochem Biophys Res Commun. 2000;278:38-43. [PubMed] [DOI] |
| 9. | Emanuelli B, Peraldi P, Filloux C, Sawka-Verhelle D, Hilton D, Van Obberghen E. SOCS-3 is an insulin-induced negative regulator of insulin signaling. J Biol Chem. 2000;275:15985-15991. [PubMed] [DOI] |
| 10. | Leonard WJ. Role of Jak kinases and STATs in cytokine signal transduction. Int J Hematol. 2001;73:271-277. [PubMed] |
| 11. | Rui L, Yuan M, Frantz D, Shoelson S, White MF. SOCS-1 and SOCS-3 block insulin signaling by ubiquitin-mediated degradation of IRS1 and IRS2. J Biol Chem. 2002;277:42394-42398. [PubMed] |
| 12. | Ueki K, Kadowaki T, Kahn CR. Role of suppressors of cytokine signaling SOCS-1 and SOCS-3 in hepatic steatosis and the metabolic syndrome. Hepatol Res. 2005;33:185-192. [PubMed] |
| 13. | Frederico MJ, Vitto MF, Cesconetto PA, Engelmann J, De Souza DR, Luz G, Pinho RA, Ropelle ER, Cintra DE, De Souza CT. Short-term inhibition of SREBP-1c expression reverses diet-induced non-alcoholic fatty liver disease in mice. Scand J Gastroenterol. 2011;46:1381-1388. [PubMed] |
| 14. | Shimano H, Horton JD, Shimomura I, Hammer RE, Brown MS, Goldstein JL. Isoform 1c of sterol regulatory element binding protein is less active than isoform 1a in livers of transgenic mice and in cultured cells. J Clin Invest. 1997;99:846-854. [PubMed] [DOI] |
| 15. | Joseph SB, Laffitte BA, Patel PH, Watson MA, Matsukuma KE, Walczak R, Collins JL, Osborne TF, Tontonoz P. Direct and indirect mechanisms for regulation of fatty acid synthase gene expression by liver X receptors. J Biol Chem. 2002;277:11019-11025. [PubMed] |
| 16. | Ueki K, Kondo T, Tseng YH, Kahn CR. Central role of suppressors of cytokine signaling proteins in hepatic steatosis, insulin resistance, and the metabolic syndrome in the mouse. Proc Natl Acad Sci U S A. 2004;101:10422-10427. [PubMed] [DOI] |