修回日期: 2013-03-05
接受日期: 2013-07-15
在线出版日期: 2013-08-18
目的: 观察葡聚糖硫酸钠(dextran sulfate sodium, DSS)对炎症性结肠炎是否存在治疗作用, 并讨论其可能的机制.
方法: 选用♂Balb/c小鼠50只随机分为对照组、模型组、丹参多酚酸盐低、中、高剂量干预组, 饮用5%DSS造模, 14 d后检测相应的指标.
结果: 与模型组比较, 各药物干预组的肠道炎症明显减轻(P<0.01). 肠黏膜组织免疫组织化学显示模型组肠黏膜CD40/CD40L阳性面积表达明显升高(分别为30.33 μm2±4.227 μm2; 27.83 μm2±3.710 μm2), 而低、中、高剂量各干预组CD40/CD40L显著下调(分别为20.50 μm2±1.517 μm2, 15.50 μm2±4.680 μm2, 13.33 μm2±0.816 μm2; 23.17 μm2±2.714 μm2, 15.50 μm2±2.739 μm2, 14.17 μm2±4.262 μm2), 具有统计学意义(P<0.01). 模型组肠黏膜CD40 mRNA表达升高(1.78%±0.41%), 低、中、高各剂量干预组CD40 mRNA明显下调, 分别为1.20%±0.30%, 0.78%±0.26%, 0.41%±0.15%(P<0.01). 模型组肠黏膜CD40L mRNA表达亦明显升高(3.54%±0.85%), 中、高剂量组可见其下调, 分别为2.59%±1.68%, 1.75%±0.64%, 1.11%±0.53%(P<0.01). 模型组小鼠可溶性CD40L(sCD40L)高于其他各组(5.62 ng/mL±0.36 ng/mL), 中、高剂量组与模型组比较sCD40L下降, 分别为2.12 ng/mL±0.18 ng/mL, 1.96 ng/mL±0.12 ng/mL(P<0.01).
结论: 丹参多酚酸盐对于小鼠实验性结肠炎具有一定的治疗作用, 可能是通过下调sCD40L, 抑制CD40/CD40炎症通路达到治疗目的.
核心提示: 丹参多酚酸盐对于小鼠实验性结肠炎具有一定的治疗作用, 可能是通过下调sCD40L, 抑制CD40/CD40L炎症通路达到治疗目的.
引文著录: 蒋晓芸, 戎兰, 宋艳艳, 蒋义斌, 钟良, 孙大裕. 丹参多酚酸盐注射液治疗小鼠实验性结肠炎的疗效. 世界华人消化杂志 2013; 21(23): 2275-2281
Revised: March 5, 2013
Accepted: July 15, 2013
Published online: August 18, 2013
AIM: To observe whether Salvianolate Injection has a therapeutic effect on colitis and to discuss the possible mechanisms involved.
METHODS: 50 Balb/c mice were randomly divided into a control group, a model group, and low-, medium-, and high-dose interventional groups. Colitis was induced by oral administration of 5% DSS for 7 d. Indices were determined 14 d after colitis induction.
RESULTS: Treatment with Salvianolate Injection could reduce colonic inflammation induced with DSS (P < 0.01). Immunohistochemistry analysis showed that treatment with different doses of Salvianolate Injection significantly reduced CD40/CD40L protein expression compared to the model group (CD40: 20.50 μm2 ± 1.517 μm2, 15.50 μm2 ± 4.680 μm2, 13.33 μm2 ± 0.816 μm2vs 30.33 μm2 ± 4.227 μm2, all P < 0.01; CD40L: 23.17 μm2 ± 2.714 μm2, 15.50 μm2 ± 2.739 μm2, 14.17 μm2 ± 4.262 μm2vs 27.83 μm2 ± 3.710 μm2, all P < 0.01). RT-PCR analysis showed that treatment with different doses of Salvianolate Injection significantly reduced CD40/CD40L mRNA expression compared to the model group (CD40: 1.20% ± 0.30%, 0.78% ± 0.26%, 0.41% ± 0.15% vs 1.78% ± 0.41%, all P < 0.01; CD40L: 2.59% ± 1.68%, 1.75% ± 0.64%, 1.11% ± 0.53% vs 3.54% ± 0.85%, all P < 0.01). The concentration of sCD40L in medium was decreased in the medium- and high-dose interventional groups compared to the model group (2.12 ng/mL ± 0.18 ng/mL, 1.96 ng/mL ± 0.12 ng/mL vs 5.62 ng/mL ± 0.36 ng/mL, P < 0.01).
CONCLUSION: Salvianolate Injection can exert a therapeutic effect on colitis in mice possibly by reducing sCD40L and thus restraining the CD40/CD40L pathway.
- Citation: Jiang XY, Rong L, Song YY, Jiang YB, Zhong L, Sun DY. Efficacy of Salvianolate Injection in the treatment of experimental colitis in mice. Shijie Huaren Xiaohua Zazhi 2013; 21(23): 2275-2281
- URL: https://www.wjgnet.com/1009-3079/full/v21/i23/2275.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i23.2275
炎症性肠病(imflammatory bowel disease, IBD)包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 其发病机制及病因至今未明, 临床治疗存在不少困难. 欧洲的一项流行病学调查显示UC的年发病率为11.2/100000, CD为5.6/100000[1]. 而国内尚无前瞻性的IBD流行病学调查, 但有研究显示, 我国IBD发病逐年增高, 且总病死率高于欧洲报道, 对整个社会及患者家庭造成了沉重的负担. 目前常用的药物主要为氨基水杨酸类、糖皮质激素类、免疫抑制剂以及生物制剂, 这些药物往往存在不可避免的不良反应. 本文首次采用丹参多酚酸治疗小鼠实验性结肠炎, 观察其疗效, 并对其可能作用机制进行初步研究.
♂Balb/c小鼠50只, 清洁级, 购自国家啮齿类实验动物种子中心上海分中心, 6-8周龄, 平均体质量22 g. 分子量5000 DSS(右旋葡聚糖硫酸钠), Sigma公司出品, 批号: BCBD6951V. 丹参多酚酸盐注射液由上海绿谷制药有限公司提供, 批号: 09118(丹参乙酸镁含量99.04%). 可溶性白细胞分化抗原40配体(sCD40L)ELISA试剂盒购自R&D公司; CD40一抗由SANTA CRUZ公司出品; CD40L一抗由Cell Signaling Technology公司出品; 即用型Rb/M多用途二抗由丹麦 DAKO公司出品; SYBRGreen PCR试剂盒购自上海达为科生物科技公司; TRIzol由Invitrogen公司出品. 引物设计使用Primer 5.0软件由Invitrogen公司合成. CD40上游引物atggagatggccactgagac, 下游引物ccgggactttaaaccacaga, 扩增片段长度180 bp. CD40L上游引物tacccccaaggcacatagag, 下游引物gaatcagtggggttgctgtt, 扩增片段长度110 bp.
XW-80A旋涡振荡器(上海青浦泸西仪器厂), K10CD干式恒温器(杭州蓝焰科技有限公司), F6/10手持式匀浆机(德国FLUKO), BDC-280e冷藏冰箱(伊莱克斯, 湖南长沙), 1-15K 3K15低温冷冻离心机(美国Sigma公司), TYPE B2生物安全柜(美国Sigma公司), ZXC型紫外杀毒车(上海跃进医用光学器械厂), ABI-7500 Real-time检测仪(美国ABI公司), Olympus BH2显微镜, Nikon 4500数码相机.
1.2.1 造模: 每日制备5%DSS溶液, 供对照组外所有小鼠自由饮用, 不再予其他饮水, 7 d可造成急性肠炎模型.
1.2.2 小鼠分组及处理: 50只小鼠随机分为对照组、模型组、丹参多酚酸盐低、中、高剂量干预组. 每组10只. 正常对照组: 每天予正常饮水. 模型组: 造模同时予生理盐水腹腔注射2 wk. 低剂量干预组: 造模同时予丹参多酚酸盐腹腔注射60 mg/(kg·d) 2 wk. 中剂量干预组: 造模同时予丹参多酚酸盐腹腔注射120 mg/(kg·d) 2 wk. 高剂量干预组: 造模同时与丹参多酚酸盐腹腔注射240 mg/(kg·d) 2 wk. 处死前称质量, 眼球采血, 3000 r/min离心, 吸取血清后分装-20 ℃深低温冰箱冻存备用. 开腹, 取肛门1 cm处以上病变明显处组织标本(约5 mm×10 mm), 部分予40 g/L中性甲醛固定, 石蜡包埋, 切片HE染色观察肠黏膜形态并做免疫组织化学染色. 部分组织深低温冰箱冻存备RT-PCR检测.
1.2.3 观察: 造模过程中观察小鼠便血情况.
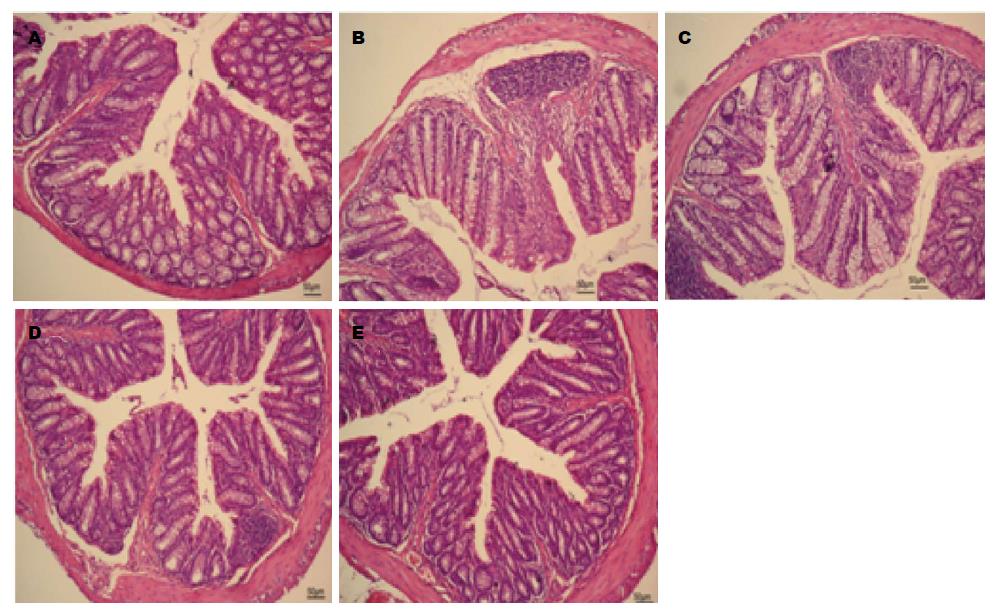
1.2.4 组织病理学评分: HE染色切片观察肠黏膜形态. 评分标准按Coopers HS组织评分, 前3项评分相加后与第4项的乘积为组织学评分.
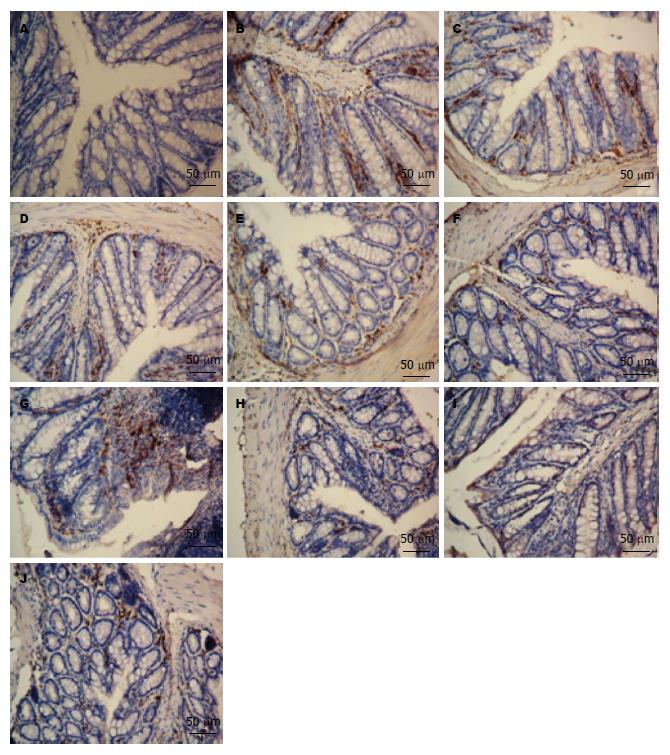
1.2.5 CD40/CD40L免疫组织化学: EnVision法, 取组织蜡块按说明书操作. 镜下观察, 细胞核紫蓝色, 阳性呈棕黄色. 测量免疫组织化学图象中阳性区域面积和阳性比率以及吸光度值(A值). 每张切片至少分析3个视野, 每组数据至少10个. CD40等阳性表达主要表现为细胞浆呈棕黄色反应, 由医学图象分析软件(上海求为生物科技有限公司MIQAS医学图象定量分析系统、医学图象定量分析软件)进行测量计算.
1.2.6 CD40/CD40L实时定量PCR: 取深低温冰箱冻存备组织, RT-PCR检测按照说明书操作, 数据采用仪器自带软件ABI Prism 7500 SDS Software分析.
1.2.7 血清sCD40L: 取深低温冰箱冻存备用血清, 按说明书操作, 根据各A值, 使用计算机软件, 绘制出标准曲线, 计算样品含量.
统计学处理 采用SPSS11.0统计软件进行统计分析. 计量资料若为正态分布且方差齐性, 进行t检验或方差分析, 否则进行Kruskal-Wallis秩和检验. 以P<0.05为差异具有统计学意义.
造模5 d后, 模型组、低剂量组小鼠广泛肛门部位有血迹; 中剂量与高剂量小鼠部分肛门部位有血迹, 正常组无明显异常. 10 d后除模型组、低剂量组小鼠外, 其余各组小鼠肛门部位血迹逐渐消失.
对照组、模型组、各干预组小鼠平均体重分别为26.90 g±0.9944 g、24.800 g±1.6193 g、25.500 g±1.2693 g、25.500 g±1.0801 g、25.500 g±1.0801 g. 各组体质量均无统计学差异.
根据各组病理评分进行统计, 正常组、模型组、低、中、高剂量组秩均值分别为3.92、22.67、20.25、20.00、10.67, 模型组炎症最重, 各干预组因剂量不同炎症程度递减, 肠道炎症情况如图1.
模型组肠黏膜CD40/CD40L表达明显升高, 而各干预组CD40/CD40L显著下调, 具有统计学意义(P<0.01). 各剂量CD40/CD40L下调情况存在一定剂量依赖关系(图2, 表1).
模型组肠黏膜CD40 mRNA表达明显升高, 各干预组CD40 mRNA则明显下调(P<0.01), 又以高剂量组效果最为明显. 模型组肠黏膜CD40L mRNA表达亦明显升高, 中、高剂量组可见其下调(P<0.01); 低剂量组与模型相比无统计学意义(P>0.05). 其中又以高剂量组效果更为明显(与对照组比较P>0.05, 表2).
丹参乙酸镁(即丹酚酸B镁盐)为主要成分的丹参多酚酸盐注射液是中国第一个拥有人体药代动力学参数的中医药制剂, 是迄今各种丹参制剂中含有效成分最明确、含量高的一个品种, 具有抗血小板聚集、抗炎、清除自由基等多种作用. 目前尚没有应用于IBD治疗的报道.
长期临床研究表明IBD患者的外周血小板计数增加且聚集反应增强. 我们在临床工作中收集炎症性肠病患者资料后亦曾报道过外周血小板计数的增多、异常活化、平均体积的变化与疾病活动及严重程度存在一定的关系[1-3]. 有观点认为血小板的变化可作用观察疾病活动的重要指标之一, 而且国内外均有类似报道[4-11].
血小板活化后能释放多种炎性介质, 促使炎症细胞聚集、趋化. 或通过调节其他炎性细胞活性, 释放更多的炎症因子通过各自的信号通路参与IBD肠黏膜的炎症反应[12], 其中CD40/CD40L系统与血小板的联系较为密切. 以往认为CD40/CD40L主要由B细胞、CD4+ T淋巴细胞、内皮细胞等表达, 但血小板表面也有CD40表达, 活化的血小板还可表达CD40L[13,14]. CD40L由胞质内区、跨膜疏水区和胞质外区组成, 其胞质外区214个氨基酸可形成可溶性蛋白, 即可溶性CD40L(sCD40L). sCD40L是CD40L在血清中的活性形式, 是反映血小板活化的主要标志之一, IBD患者的血浆sCD40L可以升高. 有文献认为血循环中95%以上的sCD40L来源于血小板, 血小板可认为是与单核细胞、T细胞同等重要的sCD40L提供者[15-20]. 表达CD40L的血小板以及从血小板脱落至血浆中的sCD40L可与CD40+的内皮细胞和T细胞等结合, 而文献显示活动期IBD肠黏膜中可见黏膜和黏膜下的单核细胞, 内皮细胞及肠间质细胞的CD40染色均为强阳性且广泛分布[21-24]. 两者结合的协同刺激可使更多细胞因子和化学因子产生, 上调细胞黏附分子, 导致炎症长期存在[21,24]. 实验中发现模型组血清sCD40L明显高于其他组, 反映了结肠炎小鼠血小板处于异常活化状态, 而中高剂量药物干预组sCD40L明显下降, 提示丹参多酚酸盐下调了血小板活化相关的sCD40L高表达, 说明其对肠道炎症的血小板活化可能具有抑制作用. 同时, 模型组小鼠无论从消化道出血症状还是镜下肠道炎症程度来说都最为严重, 免疫组织化学染色CD40L表达明显升高, CD40表达亦明显升高, 测定两者mRNA含量同样明显升高. 药物干预组与模型组比较存在显著差异, 药物干预组(特别是中高剂量组)的肠道炎症减轻, CD40/CD40L表达下降, 验证了其他研究报道的CD40/CD40L系统与肠道炎症程度的关系, 并提示丹参多酚酸盐的治疗有效.
丹参多酚酸盐已知的主要药理作用是抗血小板聚集、抑制血小板活化、抗血栓形成. 本实验发现丹参多酚酸盐可下调与血小板活化相关的sCD40L, 抑制CD40/CD40L炎症通路. 鉴于以上情况, 且药物干预组小鼠肠道炎症在未使用其他任何已知对结肠炎有治疗作用的药物的前提下出现好转, 是否能大胆推测丹参多酚酸盐可能通过抑制血小板的活化对肠道炎症起到治疗作用? 有研究发现丹酚酸B可以抑制单核细胞来源的树突状细胞表达CD40[25], 因此还需考虑丹参多酚酸盐可直接抑制单核细胞等表达CD40/CD40L起到治疗作用, 但是目前未见丹参多酚酸具有类似作用的报道. 本实验只是观察到上述现象, 而丹参多酚酸治疗肠炎的作用机制尚不完全明确, 有待完善.
以丹参乙酸镁为主要成分的丹参多酚酸盐注射液是迄今各种丹参制剂中含有效成分最明确、含量高的一个品种, 可下调多个血清炎症因子水平, 疗效确切. 临床应用至今尚无直接导致出血的报道. 研究观察40例肝硬化失代偿患者应用该药物后认为不仅没有增加出血危险反而可改善出凝血功能[26]. 另有研究表明丹参多酚酸盐在有效抗血栓形成时不影响正常凝血功能, 不引起出血[27], 有高度的安全性, 但尚无应用于治疗IBD的报道. 由于DSS诱导实验性结肠炎的动物模型在临床表现和病理改变上更接近于人类UC, 我们观察到整个研究过程中未发现有动物因药物导致出血加重, 相反能减轻出血症状, 证明了其安全性. 虽然IBD的预防性抗凝治疗尚存争议, 已有不少研究将肝素用于治疗严重或合并血栓的UC, 且取得良好疗效, 且肝素用于治疗UC的安全性还是公认的[28-31]. 相对于肝素, 丹参多酚酸盐的安全性自然更为可靠.
本实验希望能拓宽该药的临床适应症, 并为IBD新的治疗策略提供新的线索. 当然, 关于该药物的最佳剂量和更确切的作用机制还有待于更多的实验加以深入研究.
我国炎症性肠病(imflammatory bowel disease, IBD)的发病率日高, 对安全有效的治疗药物需求日盛. 血小板及其活化产物如PAF、CD40L广泛参与了炎症反应, 血小板活化在IBD发病中的所起的作用日益得到重视. 基于临床工作中的发现及各类文献的总结, 我们选用了丹参多酚酸这一安全有效的药物, 试图以抗血小板活化为切入点对结肠炎进行实验性治疗.
杨柏霖, 副主任医师, 南京中医药大学附属医院
目前炎症性肠病的研究主要集中在发病机制及相关靶点药物治疗, 白介素-23(interleukin-23, IL-23)、Toll样受体、炎症小体等各种炎症通路相关的蛋白及其拮抗剂都是药物研究的热点.
文献显示丹参多酚酸盐可使IL-1、IL-6、PAF、TNF-α、IL-1β等水平显著下降, 起到保护机体作用. 丹酚酸B可能通过抑制NF-κβ信号通路, 显著降低细胞IL-1β, TNF-α、NO水平, 并可抑制DC细胞成熟(抑制CD40等细胞膜表面蛋白的表达).
丹参多酚酸主要应用于心脑血管疾病领域, 用于IBD的治疗以往没有报道. 而从血小板功能异常方面入手治疗IBD也是全新的尝试.
药理实验证明丹参多酚酸盐可减少VCAM-1、TNF-α、ICAM-1、IL-1、IL-6, TGF-β1、ET、VEGF等释放而抑制炎症反应. 而这些炎症因子也参与了IBD的发病过程. 本研究将其应用于实验性结肠炎的治疗, 或能开发新的临床适应症.
本文是基于前期临床基础的实验研究, 为IBD的治疗提供一个可能的新治疗药物进行了初步研究, 具有一定参考价值.
编辑: 田滢 电编: 鲁亚静
| 2. | 蒋 晓芸, 戎 兰, 宋 艳艳, 钟 良, 蒋 义斌. 溃疡性结肠炎患者血小板功能变化的观察. 胃肠病学和肝病学杂志. 2008;17:59-61. |
| 10. | Yüksel O, Helvaci K, Başar O, Köklü S, Caner S, Helvaci N, Abayli E, Altiparmak E. An overlooked indicator of disease activity in ulcerative colitis: mean platelet volume. Platelets. 2009;20:277-281. [PubMed] [DOI] |
| 11. | Öztürk ZA, Dag MS, Kuyumcu ME, Cam H, Yesil Y, Yilmaz N, Aydinli M, Kadayifci A, Kepekci Y. Could platelet indices be new biomarkers for inflammatory bowel diseases? Eur Rev Med Pharmacol Sci. 2013;17:334-341. [PubMed] |
| 13. | Schönbeck U, Libby P. The CD40/CD154 receptor/ligand dyad. Cell Mol Life Sci. 2001;58:4-43. [PubMed] |
| 14. | Antoniades C, Bakogiannis C, Tousoulis D, Antonopoulos AS, Stefanadis C. The CD40/CD40 ligand system: linking inflammation with atherothrombosis. J Am Coll Cardiol. 2009;54:669-677. [PubMed] [DOI] |
| 15. | Ludwiczek O, Kaser A, Tilg H. Plasma levels of soluble CD40 ligand are elevated in inflammatory bowel diseases. Int J Colorectal Dis. 2003;18:142-147. [PubMed] |
| 17. | Danese S, Katz JA, Saibeni S, Papa A, Gasbarrini A, Vecchi M, Fiocchi C. Activated platelets are the source of elevated levels of soluble CD40 ligand in the circulation of inflammatory bowel disease patients. Gut. 2003;52:1435-1441. [PubMed] |
| 18. | Hermann A, Rauch BH, Braun M, Schrör K, Weber AA. Platelet CD40 ligand (CD40L)--subcellular localization, regulation of expression, and inhibition by clopidogrel. Platelets. 2001;12:74-82. [PubMed] |
| 19. | Nagasawa M, Zhu Y, Isoda T, Tomizawa D, Itoh S, Kajiwara M, Morio T, Nonoyama S, Shimizu N, Mizutani S. Analysis of serum soluble CD40 ligand (sCD40L) in the patients undergoing allogeneic stem cell transplantation: platelet is a major source of serum sCD40L. Eur J Haematol. 2005;74:54-60. [PubMed] |
| 20. | Heeschen C, Dimmeler S, Hamm CW, van den Brand MJ, Boersma E, Zeiher AM, Simoons ML. Soluble CD40 ligand in acute coronary syndromes. N Engl J Med. 2003;348:1104-1111. [PubMed] |
| 22. | Polese L, Angriman I, Cecchetto A, Norberto L, Scarpa M, Ruffolo C, Barollo M, Sommariva A, D'Amico DF. The role of CD40 in ulcerative colitis: histochemical analysis and clinical correlation. Eur J Gastroenterol Hepatol. 2002;14:237-241. [PubMed] |
| 23. | Borcherding F, Nitschke M, Hundorfean G, Rupp J, von Smolinski D, Bieber K, van Kooten C, Lehnert H, Fellermann K, Büning J. The CD40-CD40L pathway contributes to the proinflammatory function of intestinal epithelial cells in inflammatory bowel disease. Am J Pathol. 2010;176:1816-1827. [PubMed] [DOI] |
| 25. | Sun A, Liu H, Wang S, Shi D, Xu L, Cheng Y, Wang K, Chen K, Zou Y, Ge J. Salvianolic acid B suppresses maturation of human monocyte-derived dendritic cells by activating PPARγ. Br J Pharmacol. 2011;164:2042-2053. [PubMed] |
| 27. | Fan HY, Fu FH, Yang MY, Xu H, Zhang AH, Liu K. Antiplatelet and antithrombotic activities of salvianolic acid A. Thromb Res. 2010;126:e17-e22. [PubMed] |
| 29. | Chande N. Prevention of venous thromboembolism in hospitalized patients with inflammatory bowel disease. Inflamm Bowel Dis. 2013;19:669-671. [PubMed] [DOI] |
| 30. | Chande N, McDonald JW, Macdonald JK, Wang JJ. Unfractionated or low-molecular weight heparin for induction of remission in ulcerative colitis. Cochrane Database Syst Rev. 2010;CD006774. [PubMed] [DOI] |
| 31. | Stadnicki A. Involvement of coagulation and hemostasis in inflammatory bowel diseases. Curr Vasc Pharmacol. 2012;10:659-669. [PubMed] |