修回日期: 2012-11-25
接受日期: 2012-12-03
在线出版日期: 2012-12-18
目的: 制备半乳糖-羧化壳聚糖-十四酸纳米粒(galactose carboxyl chitosan myristic acid nanoparticles, GCCMA), 观察GCCMA纳米粒在肝癌细胞中的靶向性.
方法: 本实验组采用自组装法制备GCCMA纳米粒, 优化制备条件, 并经过本实验组鉴定稳定性及生物相容性, 纳米粒经荧光标记后分别取不同浓度转染肝癌细胞及HT22海马神经细胞, 对照组、HT22海马神经细胞组和肝癌细胞组, 以及对照组、肝癌细胞-low组、肝癌细胞-mid组和肝癌细胞-high组(置入的GCCMA纳米粒浓度由低到高), 分别于1、2和4 h时间点测定在细胞摄取纳米粒情况.
结果: 相同浓度的GCCMA纳米粒, Huh7肝癌细胞摄取量显著高于HT22海马神经细胞, 肝癌细胞摄取量在特定区间有剂量依赖性, 较高浓度时摄取量较大, 在1、2和4 h时间点所测定的结果显示, 4 h时肝癌细胞的摄取量最大.
结论: GCCMA纳米粒有肝靶向性, 为肝脏肿瘤的靶向性基因治疗或化疗药物提供很好的药物载体及给药途径.
引文著录: 寇昌华, 钱海鑫, 韩锡林, 汤仁仙, 温相如, 赵子明, 宋远见, 戚大石, 刘红芝, 刘雯, 马向东. 半乳糖-羧化壳聚糖-十四酸纳米粒的制备及其肝靶向性. 世界华人消化杂志 2012; 20(35): 3570-3574
Revised: November 25, 2012
Accepted: December 3, 2012
Published online: December 18, 2012
AIM: To prepare galactose-carboxyl chitosan-myristic acid (GCCMA) nanoparticles and to obverse their targeting of hepatoma carcinoma cells (HCCs).
METHODS: GCCMA nanoparticles were prepared by self-assembled technology, and their stability and biocompatibility were assessed. After fluorescent labeling, GCCMA nanoparticles of different concentrations were transfected into HCCs and HT22 hippocampal neurons. Non-transfected HCCs and HT22 hippocampal neurons were used as controls. Based on the concentrations of GCCMA nanoparticles, HCCs transfected with GCCMA nanoparticles were divided into low-, medium- and high-concentration groups. The cellular uptake of nanoparticles was determined at 1, 2 and 4 h after transfection.
RESULTS: The cellular uptake of nanoparticles in the HCC group was much higher than that in the HT22 hippocampal neuron group. The uptake of nanoparticles in the HCC group was dose-dependent. The highest uptake of nanoparticles in the HCC group was observed at 4 hours after transfection.
CONCLUSION: GCCMA nanoparticles show hepatic targeting and are therefore a potential drug-carrier or administration route for chemotherapy drugs or targeted gene therapy for hepatic tumors.
- Citation: Kou CH, Qian HX, Han XL, Tang RX, Wen XR, Zhao ZM, Song YJ, Qi DS, Liu HZ, Liu W, Ma XD. Preparation of liver-targeted galactose-carboxyl chitosan-myristic acid nanoparticles. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3570-3574
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3570.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3570
原发性肝癌及继发性肝癌临床上均较为常见, 肝脏的靶向给药能够改善此类患者的预后. 纳米技术是20世纪80年代末发展起来的交叉性新兴前沿学科. 纳米科技已涉及到医学研究的众多方面, 纳米生物医学正在迅速形成一个崭新的研究领域[1]. 纳米药物可提高药物的靶向性, 从而提高疗效, 减少对其他正常器官、组织的不良反应[2]. 本实验组以自组装法合成半乳糖-羧化壳聚糖-十四酸纳米粒(galactose carboxyl chitosan myristic acid nanoparticles, GCCMA), 既往通过核磁、红外、热重、X光衍射等方法鉴定和表征了纳米粒[3,4]. GCCMA在体内通过水解作用而降解, 浓度控制适当, 其降解产物对人体基本无毒性[5], 本研究旨在对GCCMA肝靶向性的探讨, 为后续研究奠定基础.
乳糖酸钠, 苏州亚科化学试剂股份有限公司; 羧化壳聚糖(20 000 kDa), 浙江金壳生物化学有限公司; 十四酸、罗丹明B、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl)、N-羟基琥珀酰亚胺(HOSU)、阿拉丁试剂; Huh7肝癌细胞由徐州医学院基础学院汤仁仙教授提供; SK3200H超声波清洗器(超声波清洗器); R-134旋转蒸发仪(瑞士Buchi公司); FD-1冷冻干燥机(北京博医康实验仪器有限公司); DF-101S集热式磁力搅拌器(巩义市科华仪器有限公司); 3162CO2培养箱(美国Sheldon公司); 5417R高速冷冻离心机(德国Eppendorf公司); CK2倒置相差显微镜(日本Olympus公司); CKX41-F32FL荧光显微镜(日本Olympus公司); YJ-1450超净工作台(苏州净化设备公司).
1.2.1 纳米粒的制备: 称取羧化壳聚糖溶于水中, 搅拌使之溶解均匀, 制得羧化壳聚糖溶液. 另称取十四酸、HOSU和EDC·HCl溶于二氯甲烷中, 室温下搅拌反应1 h, 旋转蒸发使之干燥后, 以无水乙醇溶解, 搅拌中滴加到羧化壳聚糖溶液中, 搅拌反应2 h, 将反应所得溶液倒入透析袋中透析24 h. 称取乳糖酸钠、HOSU和EDC·HCl溶于水中, 搅拌反应1 h, 再与透析液混合, 搅拌反后将反应液倒入透析袋透析24 h, 即得GCCMA悬液(亲水部向外, 疏水部向外, 自组装成纳米粒), 冷冻干燥后即得冻干粉末.
1.2.2 细胞培养及试剂配制: Huh7肝癌细胞及HT22海马神经细胞以含10%小牛血清的DMEM细胞培养液于37 ℃、5%CO2的培养箱中培养; 3-4 d细胞长满瓶底80%, 采用0.25%胰蛋白酶消化进行细胞传代, 取对数生长期的细胞悬液, 测定活细胞数95%以上, 稀释为2×105/0.2 mL, 铺于24孔板, 每孔0.2 mL, GCCMA稀释至2 mg/mL, 避光保存备用, 待细胞培养24 h贴壁后加入GCCMA观察.
1.2.3 实验分组: (1)Control组、HT22海马神经细胞组和肝癌细胞组; 每组样本量为5个, HT22海马神经细胞组为HT22海马神经细胞加入罗丹明标记的GCCMA 150 μL, 肝癌细胞组为Huh7肝癌细胞加入罗丹明标记的GCCMA 150 μL, Control组为Huh7肝癌细胞仅加入同浓度的罗丹明, 分别于1、2和4 h时间点测定细胞摄取纳米粒情况; (2)Control组、肝癌细胞-low组、肝癌细胞-mid组和肝癌细胞-high组; 每组样本量为5个, 肝癌细胞-low组、肝癌细胞-mid组和肝癌细胞-high组分别加入罗丹明标记的GCCMA(浓度为2 mg/mL)75、150、300 μL, 分别于1、2和4 h时间点用PBS洗涤3次, 每次5 min, 测定细胞摄取纳米粒情况, Control组仅加入等浓度的罗丹明, 转染2 h作对照.
1.2.4 罗丹明B标记纳米粒: 罗丹明B(rhodamine B, RB)标记纳米粒的制备: 称取5 mg RB溶于10 mL稀醋酸(pH 4.5-5.0)中, 加入2 mg EDC·HCI和2 mg N-羟基琥珀酰亚胺(N-hydroxysuccinimide, NHS), 避光搅拌l h, 加入10 mg GCCMA的水溶液(2 mg/mL), 常温避光搅拌24 h. 以12 000 r/min离心20 min, 弃上清, 沉淀以20 mL水复溶, 再次以12 000 r/min离心20 min, 弃上清, 重复洗至上清液测不出游离RB的荧光.
1.2.5 荧光显微观察: 荧光显微照片. 观察纳米粒在细胞质和细胞核中均有分布, 以纳米粒荧光强度, 统计细胞对纳米粒的摄取量.
统计学处理 采用SPSS16.0统计软件, 组间比较采用方差分析.
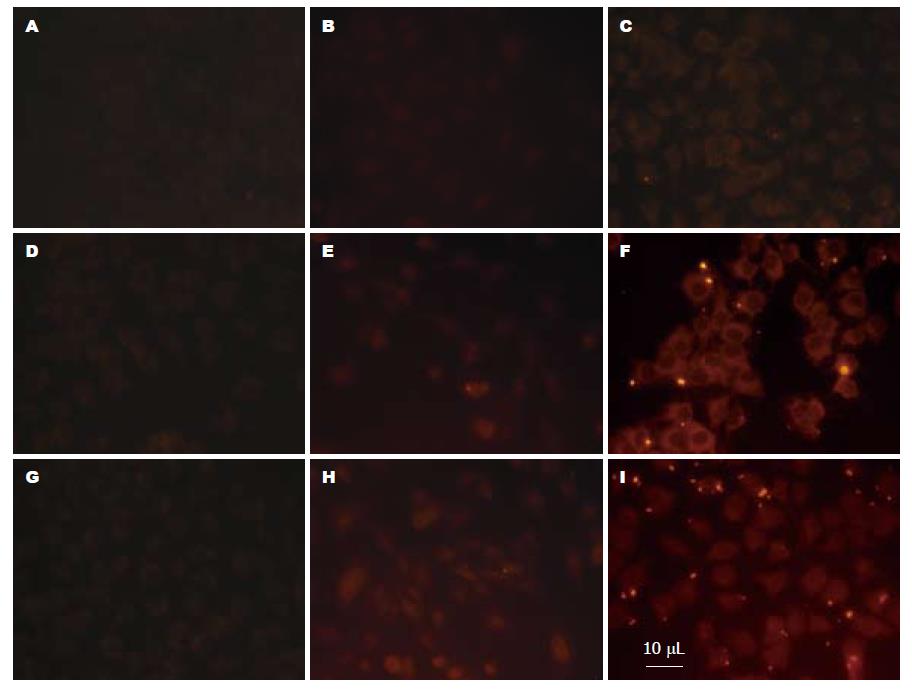
图1显示: 肝癌细胞(图1C, F, I)及HT22海马神经细胞(图1B, E, H)摄取纳米粒的对比, 各组分别转染1 h(图1A, B, C)、2 h(图1D, E, F)和4 h(图1G, H, I)时, 肝癌细胞组的荧光强度均显著高于相应时间点的HT22海马神经细胞中的荧光强度, 表明该纳米粒有明确的肝靶向性.
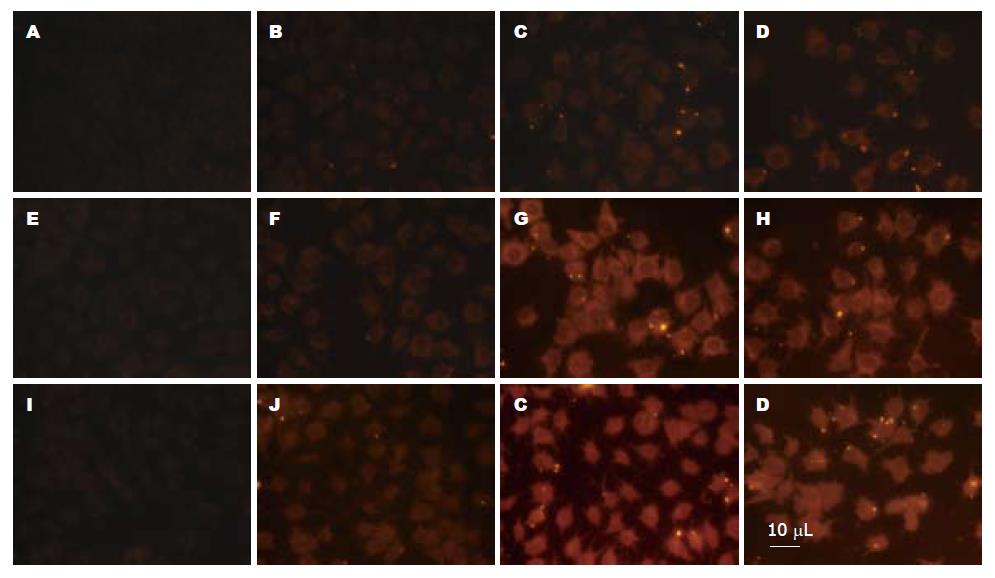
图2显示肝癌细胞-low组(图2B, C, D)、肝癌细胞-mid组(图2F, G, H)和肝癌细胞-high组(图2J, K, L), 分别加入纳米粒(浓度为2 mg/mL)75、150、300 μL. 洗涤后观察荧光强度, 随纳米粒浓度的增加, 细胞摄取纳米粒也随之增高. 结果表明: 在试验所选取的浓度, 细胞摄取纳米粒的量随GCCMA纳米粒浓度升高而渐增加.
纳米粒子(nanoparticles, Nps)是直径在10-1 000 nm之间的固态胶体粒子, 纳米粒的大小及分子结构使得纳米粒载药系统肿瘤的治疗具有很多优势, 纳米粒可通过各种物理、化学及生物作用包载药物, 改变给药途径, 并在给药途中保护药物不被降解, 提高药物稳定性, 降低药物的不良反应, 并能通过多种生物屏障[6,7], 提高药物作用的靶向性, 还有缓释的作用, 提高药物纳米粒载药系统的开发, 为肝肿瘤的治疗开辟了新的给药途径. 通过纳米粒可延长药物在靶向器官内的存留时间, 增加局部药物浓度, 从而在不同细胞周期发挥持续的抗肿瘤作用. 他与游离药物相比明显提高了药物疗效, 并可省去肝脏介入给药治疗的不便和费用. 特别是随着对原发性肝癌基因治疗的深入研究, 利用纳米载体介导的基因治疗已成为一个重要发展趋势.
纳米粒多由天然或人工合成的高分子聚合物构成. 天然材料的NPs结构和成分不均一, 使药物的释放不均一、性能不稳定、不易长期保存. 人工合成的高分子聚合物具有生物降解好、载药量高、性能稳定、易于制备及保存的特点[2]. NPs中的药物可通过沥滤、渗透和扩散或通过基质的溶蚀而缓慢释放出来[8]. 纳米结构介导的药物输送是一个关键技术. 理想的NPs载体应具有较高的载药量及药物包封率、特异靶向性、药物释放可控性、载体材料可生物降解、毒性较低或无毒等特点; 并有提高药物的生物可利用度、改进药物的时间控制释放性能等特性[4]. 当前研究的用于制备药物输送载体的NPs主要包括: (1)天然高分子聚合物: 蛋白、壳聚糖、明胶、海澡酸钠、多糖等生物型粒子; (2)人工合成的可生物降解的聚合物体系: 聚氰基丙烯酸酯、聚乳酸、聚乙醇酸、乳酸一乙醇酸共聚物、聚己内酯等; 其他: 硅基粒子、碳基粒子以及金属粒子等[8,9].
壳聚糖是一种具有优良的生物相容性及易于降解的聚合物, 其代谢产物为人体内正常的代谢产物[10,11], 本研究采用自组装法合成GCCMA, 为人工合成的可生物降解的聚合物体系, 合成成分能安全降解, 生物安全性高, 为其在体内广泛应用打下了基础; 制备方法简单、方便, 但影响因素较多, 应根据不同要求和不同药物确定最佳制备工艺, 制备的纳米粒粒径在300-400 nm, 为进一步研究奠定了基础. 本实验组合成的GCCMA, 通过核磁、红外、热重及X光衍射等方法鉴定纳米粒的稳定性及生物相容性. 研究表明: 半乳糖有肝细胞的选择性[12,13], GCCMA为耦联特异性的靶向分子半乳糖, GCCMA纳米粒主动与细胞表面特异性受体结合[14,15], 从而提高肝脏药物浓度, 提高疗效, 减少对其他正常器官、组织的不良反应.
实验中我们将Huh7肝癌细胞与HT22海马神经细胞对GCCMA的选择性摄取做了对比实验. 从图1中发现: Huh7肝癌细胞对GCCMA纳米粒的选择性摄取显著高于HT22海马神经细胞及对照组, 能够较好的表明GCCMA纳米粒的肝靶向性. 并且我们在不同纳米粒浓度及作用时间对肝癌细胞摄取GCCMA纳米量的影响做了研究, 图2提示: 在4 h内, 随着实验时间的延长, 摄取量增加, 时间的延长能够增加肝癌细胞摄取GCCMA的量, 在我们选择的GCCMA浓度区间内, 即浓度在0.4-1.2 mg/mL左右, 浓度较高肝癌细胞摄取GCCMA的量较大.
随着纳米技术的飞速发展, NPs将在肝癌的治疗中发挥越来越重要的作用. 特别是作为一种良好的化疗药物及基因载体, NPs可有效解决目前药物载体的免疫原性、安全性、低转染率和靶向性等诸多问题, 具有广阔的应用前景[16].
氧化低密度脂蛋白(Ox-LDL)通常被认为是致动脉粥样硬化的关键作用物, 近年来研究发现Ox-LDL在梗阻性黄疸和肝脏的纤维化中发挥重要的作用.
党双锁, 教授, 西安交通大学医学院第二附属医院感染科
Fellstrom等研究发现瑞舒伐他汀钙可以降低终末期肾病的血液透析患者血浆中Ox-LDL的水平.
本研究发现瑞舒伐他汀钙能下调Ox-LDL在肝脏的表达, 和肝脏的纤维化也存在一定的联系.
本实验设计合理, 紧密结合临床, 方法正确, 结果分析恰当, 对临床使用瑞舒伐他汀钙治疗慢性梗阻性黄疸大鼠肝脏纤维化提供了一定的实验依据.
编辑: 田滢 电编:闫晋利
| 1. | Lin X, Xie J, Niu G, Zhang F, Gao H, Yang M, Quan Q, Aronova MA, Zhang G, Lee S. Chimeric ferritin nanocages for multiple function loading and multimodal imaging. Nano Lett. 2011;11:814-819. [PubMed] [DOI] |
| 2. | Sánchez-Moreno P, Ortega-Vinuesa JL, Martín-Rodríguez A, Boulaiz H, Marchal-Corrales JA, Peula-García JM. Characterization of different functionalized lipidic nanocapsules as potential drug carriers. Int J Mol Sci. 2012;13:2405-2424. [PubMed] [DOI] |
| 3. | Seo SJ, Kim IY, Choi YJ, Akaike T, Cho CS. Enhanced liver functions of hepatocytes cocultured with NIH 3T3 in the alginate/galactosylated chitosan scaffold. Biomaterials. 2006;27:1487-1495. [PubMed] [DOI] |
| 4. | Feng ZQ, Chu X, Huang NP, Wang T, Wang Y, Shi X, Ding Y, Gu ZZ. The effect of nanofibrous galactosylated chitosan scaffolds on the formation of rat primary hepatocyte aggregates and the maintenance of liver function. Biomaterials. 2009;30:2753-2763. [PubMed] [DOI] |
| 5. | Mahapatro A, Singh DK. Biodegradable nanoparticles are excellent vehicle for site directed in-vivo delivery of drugs and vaccines. J Nanobiotechnology. 2011;9:55. [PubMed] [DOI] |
| 6. | Siddiqui IA, Adhami VM, Ahmad N, Mukhtar H. Nanochemoprevention: sustained release of bioactive food components for cancer prevention. Nutr Cancer. 2010;62:883-890. [PubMed] [DOI] |
| 8. | Vanpouille-Box C, Lacoeuille F, Roux J, Aubé C, Garcion E, Lepareur N, Oberti F, Bouchet F, Noiret N, Garin E. Lipid nanocapsules loaded with rhenium-188 reduce tumor progression in a rat hepatocellular carcinoma model. PLoS One. 2011;6:e16926. [PubMed] [DOI] |
| 9. | Ghosn B, Singh A, Li M, Vlassov AV, Burnett C, Puri N, Roy K. Efficient gene silencing in lungs and liver using imidazole-modified chitosan as a nanocarrier for small interfering RNA. Oligonucleotides. 2010;20:163-172. [PubMed] [DOI] |
| 11. | Yao HT, Luo MN, Hung LB, Chiang MT, Lin JH, Lii CK, Huang CY. Effects of chitosan oligosaccharides on drug-metabolizing enzymes in rat liver and kidneys. Food Chem Toxicol. 2012;50:1171-1177. [PubMed] [DOI] |
| 12. | Mukthavaram R, Marepally S, Venkata MY, Vegi GN, Sistla R, Chaudhuri A. Cationic glycolipids with cyclic and open galactose head groups for the selective targeting of genes to mouse liver. Biomaterials. 2009;30:2369-2384. [PubMed] [DOI] |
| 13. | Nakamura K, Okuno K, Hirohata T, Shigeoka H, Jinnai H, Yasutomi M. [Selective effectiveness of galactose-containing liposome IL-2 on liver lymphocytes]. Gan To Kagaku Ryoho. 1994;21:2105-2107. [PubMed] |
| 14. | Massimi M, Devirgiliis LC, Kolb-Bachofen V, Dini L. Independent modulation of galactose-specific receptor expression in rat liver cells. Hepatology. 1995;22:1819-1828 [PMID: 7489994] 15 Dini L, Falasca L, Lentini A, Mattioli P, Piacentini M, Piredda L, Autuori F. Galactose-specific receptor modulation related to the onset of apoptosis in rat liver. Eur J Cell Biol 1993; 61: 329-33. [PubMed] |
| 15. | Liu M, Li ZH, Xu FJ, Lai LH, Wang QQ, Tang GP, Yang WT. An oligopeptide ligand-mediated therapeutic gene nanocomplex for liver cancer-targeted therapy. Biomaterials. 2012;33:2240-2250. [PubMed] [DOI] |