修回日期: 2012-11-15
接受日期: 2012-12-03
在线出版日期: 2012-12-18
目的: 研究MicroRNA-451(MiR-451)作用于巨噬细胞迁移抑制因子(macrophage migration inhibitory factor, MIF)对人大肠癌细胞株LoVo的影响.
方法: 构建包含有MiR-451过表达的慢病毒(hsa-mir-451a), 感染LoVo细胞株, 采用实时荧光定量PCR及Western blot技术检测MIF mRNA及蛋白在人大肠癌细胞LoVo及人大肠上皮细胞FHC中的表达变化情况, MTT法检测各组细胞的增殖能力.
结果: 与未感染组及对照组相比, 感染组中MIF在mRNA及蛋白水平的表达均显著降低, 感染组细胞的增殖活性明显受到抑制.
结论: MIF可能是miR-451的直接作用靶点, 高表达miR-451可以有效抑制LoVo中MIF的表达, 进而抑制了LoVo的增殖.
引文著录: 孔帅, 陶凯雄, 王国斌. MiR-451作用于MIF对大肠癌细胞株LoVo的影响. 世界华人消化杂志 2012; 20(35): 3452-3456
Revised: November 15, 2012
Accepted: December 3, 2012
Published online: December 18, 2012
AIM: To investigate the effect of miR-451-mediated regulation of macrophage migration inhibitory factor (MIF) expression on cell proliferation in human colon carcinoma cell line LoVo.
METHODS: A lentiviral vector overexpressing hsa-mir-451a was designed and used to infect LoVo cells. Real-time quantitative PCR and Western blot were utilized to detect the expression levels of MIF mRNA and protein in LoVo cells and fetal colon cells. Cell proliferation was determined by MTT assay after infection.
RESULTS: The expression of MIF mRNA and protein decreased significantly and cell proliferation was significantly inhibited in LoVo cells infected with the lentiviral vector overexpressing hsa-mir-451a compared to non-infected LoVo cells and fetal colon cells.
CONCLUSION: MIF is a potential target gene of miR-451. Overexpression of miR-451 could suppress LoVo cell proliferation by down-regulating MIF expression.
- Citation: Kong S, Tao KX, Wang GB. Effect of miR-451-mediated regulation of MIF expression on cell proliferation in human colon carcinoma cell line LoVo. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3452-3456
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3452.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3452
大肠癌是消化系统最常见的恶性肿瘤之一, 随着分子生物学研究的进展, 大肠癌的发生发展被发现与许多基因和细胞因子有关. 微小RNA(microRNA, miRNA)是一种在转录后水平调控基因表达的长度约为22 nt的非编码单链小RNA分子[1], 他可以通过增加mRNA的降解或抑制翻译来调控目的基因[2,3], 在调节细胞的增殖、分化和凋亡方面有重要作用[1,4], 且许多miRNA在肿瘤的发生发展过程中或者肿瘤抑制方面扮演重要角色[5-7]. MicroRNA-451(MiR-451)是在血液系统疾病、神经系统疾病、癌症等发生过程中有重要意义的一个miRNA[8-10], 其在胶质母细胞瘤、胃癌、大肠癌等组织及细胞系中表达降低[10,11]. 巨噬细胞迁移抑制因子(macrophage migration inhibitory factor, MIF)是近年来研究较多的一个细胞因子, 他是一种多能性的细胞因子, 被认为与免疫及炎症反应广泛相关[12]. 有研究表明MIF与肿瘤的生长、增殖、转移等有密切联系, 而且其在乳腺癌、肺癌、肝癌、前列腺癌等肿瘤中表达明显上调[13,14]. 我们在前期的实验中也已经证实在大肠癌细胞中MIF呈高表达. Bandres等[10]研究发现MiR-451在胃癌和大肠癌细胞中有抑癌作用, 并且通过生物信息学分析和芯片技术发现MIF可能是MiR-451的潜在靶点. 本实验通过构建包含MiR-451的过表达慢病毒(hsa-mir-451a)并感染大肠癌细胞LoVo, 检测MIF基因和蛋白的表达变化情况, 并观察其对大肠癌细胞增殖的影响.
人大肠癌细胞LoVo和人大肠上皮细胞FHC均购自中国典型培养物保藏中心; DMEM(高糖)、DMEM/F12 1:1细胞培养基、10%胎牛血清以及青霉素、链霉素双抗均购自Gibco公司; MiR-451的高表达慢病毒由上海吉凯基因化学技术有限公司构建, 含有编码增强型绿色荧光蛋白(EGFP)的报告基因, 同时构建不包含特异性miRNA的慢病毒作为阴性对照; 感染添加剂Polybrene也由上海吉凯基因化学技术有限公司提供; TRIzol Reagent、逆转录试剂盒购自Invitrogen公司; SYBR Green mix购自BIO-RAD公司; 蛋白裂解液购自碧云天公司; 一抗和二抗分别为武汉博士德生物技术有限公司(BA20580)和GE-Healthcare公司(NA934-1ML)产品; 显影液、定影液均购自苏星公司; 噻唑蓝(MTT)、二甲基亚砜(DMSO)为Sigma公司产品.
1.2.1 细胞培养: LoVo细胞使用含10%胎牛血清的DMEM/F12 1:1培养基培养, 添加1%的青霉素、链霉素双抗, FHC细胞使用含10%胎牛血清的DMEM高糖培养基培养, 添加1%的双抗, 在37 ℃、50 mL/L CO2、相对湿度为90%的培养箱中培养, 48-72 h换液1次, 用0.25%胰蛋白酶常规消化, 按1:4或1:5比例传代, 在对数生长期进行实验.
1.2.2 慢病毒感染细胞: 参照上海吉凯基因化学技术有限公司的Lentivirus使用操作手册进行操作. 将处于对数生长期的LoVo细胞接种于96孔细胞培养板, 当细胞融合大约50%时进行感染. 感染实验分为3组: 感染组(MiR-451)、阴性对照组(Control)、未感染组(Empty). 以感染复数MOI为10的条件进行实验, 在加入慢病毒的同时在培养基中添加8 μg/mL的polybrene, 感染24 h后更换含血清的培养基. 72 h后在荧光显微镜下观察感染效果.
1.2.3 Real-time PCR检测MIF mRNA的表达: 收集感染后72 h的细胞, 用TRIzol法提取感染实验各组及FHC组细胞的总RNA, 逆转录合成cDNA. Real-time PCR扩增引物由安基生物提供, MIF上游引物为5'-AGAACCGCTCCTACAGCAAGCT-3', 下游引物为5'-GGAGTTGTTCCAGCCCACATTG-3', 以GAPDH为内参, 上游引物为5'-GTCTCCTCTGACTTCAACAGCG-3', 下游引物为5'-ACCACCCTGTTGCTGTAGCCAA-3'. 应用美国BIO-RAD CFX96实时荧光定量PCR仪进行扩增, Real-time PCR总反应体系为25 μL, 其中SYBR Green mix 12.5 μL, 上下游引物(5 pmol/μL)各1 μL, ddH2O 8 μL, cDNA(10倍稀释)2.5 μL. 反应条件为: 95 ℃预变性3 min, 95 ℃变性10 s, 60 ℃退火30 s, 65 ℃延伸5 s, 反应40个循环. 采用2-△△Ct法分析结果得到标本中MIF mRNA的相对表达水平. 每组设5个复孔, 每孔3个平行样, 取平均值.
1.2.4 Western blot检测MIF蛋白的表达: 收集感染后72 h的细胞, 取适量RIPA裂解液冰上裂解30 min, 14 000 r/min 4 ℃离心15 min, 取上清, 加入2×SDS Loading Buffer. 根据蛋白分子量配12%的PAGE胶电泳. 根据预染Marker显示判断目的蛋白得到充分分离后, 停止电泳. 用湿转法200 mA电流转膜80 min后, 用含5%脱脂奶粉的TBST浸泡PVDF膜, 室温摇床封闭2 h. 然后用洗涤液1:500稀释相应的一抗, 将PVDF膜浸泡于一抗孵育液中, 4℃孵育过夜. TBST充分洗涤PVDF膜5-6次, 5 min/次. 用封闭液1:20 000稀释相应的二抗, 将PVDF膜浸泡于二抗孵育液中, 室温摇床孵育2 h. TBST充分洗涤PVDF膜5-6次, 5 min/次. 每张膜滴加适量的ECL底物液, 孵育数分钟. 待荧光带明显后, 用滤纸吸去多余的底物液, 覆上保鲜膜, X光胶片压片后依次放入显影液显影、定影液定影. 用BIO-RAD Quantity One软件扫描胶片灰度值以分析各组细胞的相对蛋白表达值, 以β-actin为内参对照.
1.2.5 噻唑蓝(MTT)法检测肿瘤细胞的增殖: 在96孔细胞培养板中接种细胞, 2×103个细胞/孔, 每孔体积100 µL. 感染后72 h, 每孔加入MTT溶液(5 mg/mL), 孵育4 h, 终止培养, 去上清, 每孔加入100 µL二甲基亚砜(DMSO), 震荡30 min. 选择492 nm波长, 在酶联免疫监测仪上测定各孔光的吸收值, 记录结果.
统计学处理 应用SPSS13.0进行分析, 数据以mean±SD表示, 组间比较采用单因素方差分析, P<0.05为差异有统计学意义.
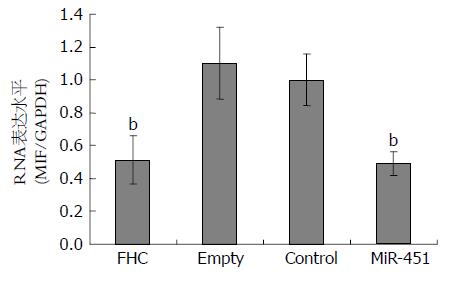
Real-time PCR结果显示(图2), MiR-451组细胞MIF mRNA表达量较Empty组(P = 0.006)和Control组(P = 0.001)均明显下调, 与FHC组比较无显著性差异(P = 0.997). Control组和Empty组比较差异无统计学意义.
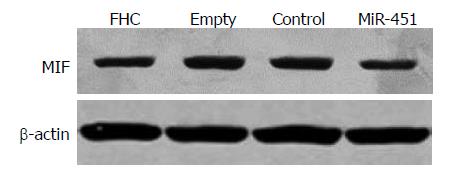
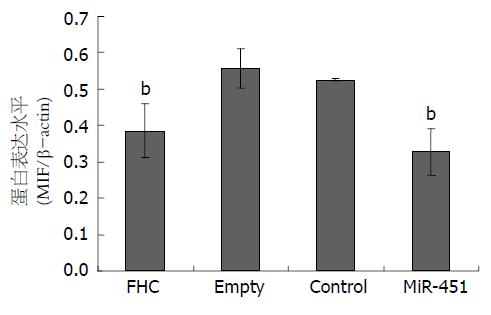
Western blot条带如图3, 结果显示, MiR-451组细胞MIF蛋白的表达量较Empty组(P = 0.001)和Control组(P = 0.003)均明显下调, 与FHC组比较无显著性差异(P = 0.237). Control组和Empty组比较差异无统计学意义(P = 0.503, 图4).
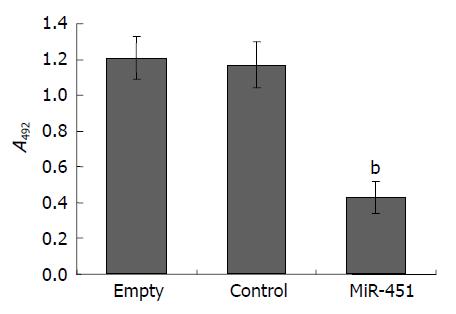
MTT结果显示, MiR-451组细胞较Empty组和Control组增殖活性明显受到抑制(P = 0.006), Control组和Empty组比较差异无统计学意义(P = 0.532, 图5).
miRNA是一类进化上保守的非编码小分子RNA, 编码他的DNA在细胞核内转录成较长的初始产物pri-miRNA, 然后被Drosha RNase切割成具有发夹结构的前体pre-miRNA, 之后通过Exportin5核输出蛋白转运到细胞质中, 再被Dicer酶切割成成熟的miRNA产物. 他通过形成非对称的基因沉默复合物, 与序列基本互补(非完全互补)的mRNA结合并阻止其翻译[15]. 他可以在转录水平调控基因表达, 具有全局性的调控作用. miRNA在正常细胞功能的形成和维持过程中起重要作用, 其表达的改变可以导致肿瘤的发生发展. 大肠癌中有很多miRNA呈异常表达, 起类似癌基因或抑癌基因的作用, 而且其表达可能与大肠癌的微卫星不稳定有关[16]. miRNA-451是一个在大肠癌中低表达的miRNA[17]. Bitarte等[18]发现miR-451可以抑制结肠肿瘤干细胞的自我复制、致瘤性和对化疗药物的抵抗.
MIF是一种多功能性的细胞因子, 来源于垂体前叶和单核巨噬细胞. 他有催化活性、信号调整和促炎等多种作用, 并参与淋巴免疫、内分泌调节等[12], 其调节异常是很多炎症和自身免疫性疾病发病的关键因素[19,20]. 近年来, 很多研究发现MIF与恶性肿瘤的发生发展有密切关系. MIF可以通过激活CD74和促分裂原活化蛋白激酶MAPK家族成员, 促进细胞外调节蛋白激酶ERK的持续活化作用, 后者进而促进了RAS基因的突变[21]. MIF还可以破坏抑癌基因p53的肿瘤抑制作用[22]. 另有研究表明, MIF可以促进血管内皮生长因子生成、促进血管的再生进而促进肿瘤的生长和转移[23,24]. 还有学者发现通过增加外源性的MIF可以促进肿瘤细胞的生长增殖并且抑制细胞凋亡. 多个研究发现其在鼻咽癌、前列腺癌、胃癌等肿瘤组织中呈高表达[25-30].
本研究采用体外实验的方法, 应用慢病毒感染LoVo细胞稳定高表达MiR-451, 结果表明相对于未感染组和对照组, 感染组细胞中MIF的表达被明显抑制, 而且感染组细胞的增殖活性也明显受到抑制. Lee等[31]在2008年的研究表明: 大肠癌患者血清中的MIF水平显著升高, 而且MIF相对CEA在大肠癌的早期检测中更加敏感. 这与我们前期实验中证实LoVo细胞中MIF高表达的结论相一致. Brandres等[10]将pre-miR-451转染入大肠癌细胞中, 发现抑制了肿瘤细胞的生长, 增加了其对放射线的敏感性, 并且他们提出MIF可能是MiR-451的潜在靶点. 因此我们推测, 感染慢病毒前后LoVo细胞中MIF的表达变化, 可能是由于其作为MiR-451的直接作用靶点被沉默, 进而导致了肿瘤细胞的增殖活性下降. 一个miRNA可能有多个靶基因, 而一个靶基因又可能由多个miRNA调控, 二者的关系错综复杂, miR-451对大肠癌细胞的抑制作用是否还存在其他的调控靶点, MIF在大肠癌细胞中是否也受其他miRNA的调控, 我们可以通过进一步的实验研究其调控机制, 进一步了解其在大肠癌发生发展中的作用, 以期为大肠癌的分子靶向治疗提供理论基础和新的思路.
大肠癌是消化系统最常见的恶性肿瘤之一, 现代分子生物学研究发现大肠癌的发生发展与许多基因和细胞因子有关.巨噬细胞迁移抑制因子(MIF)是近年来研究较多的一种多能性的细胞因子, 与肿瘤的生长、增殖、转移等有密切联系.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
MicroRNA在肿瘤的发生发展中起重要作用, 对肿瘤基因具有重要的调控作用, 是当前分子生物学和肿瘤学研究的热点, 而探索其作用靶点及调控机制是当前亟待研究的问题.
Calandra等研究发现MIF与肿瘤的生长、增殖、转移等有密切联系. Bandres等研究发现MiR-451在胃癌和大肠癌细胞中有抑癌作用, MIF在大肠癌细胞中表达增高, 并且通过生物信息学分析和芯片技术发现MIF可能是MiR-451的潜在靶点.
本文首次应用慢病毒感染LoVo细胞稳定高表达MiR-451, 通过抑制MIF的表达, 抑制了LoVo细胞的增殖, 在体外实验中进一步证实了MIF可能是MiR-451的直接作用靶点.
巨噬细胞迁移抑制因子(MIF): 一种多功能性的细胞因子, 与恶性肿瘤的发生发展有密切关系, 其在大肠癌细胞中高表达, 与大肠癌的发生发展有一定联系.
本文研究目的明确, 统计学方法合理, 数据及结论可信, 对指导临床有重要意义.
| 2. | Engels BM, Hutvagner G. Principles and effects of microRNA-mediated post-transcriptional gene regulation. Oncogene. 2006;25:6163-6169. [PubMed] [DOI] |
| 3. | Lim LP, Lau NC, Garrett-Engele P, Grimson A, Schelter JM, Castle J, Bartel DP, Linsley PS, Johnson JM. Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs. Nature. 2005;433:769-773. [PubMed] [DOI] |
| 4. | Hwang HW, Mendell JT. MicroRNAs in cell proliferation, cell death, and tumorigenesis. Br J Cancer. 2006;94:776-780. [PubMed] [DOI] |
| 5. | Iorio MV, Ferracin M, Liu CG, Veronese A, Spizzo R, Sabbioni S, Magri E, Pedriali M, Fabbri M, Campiglio M. MicroRNA gene expression deregulation in human breast cancer. Cancer Res. 2005;65:7065-7070. [PubMed] [DOI] |
| 7. | Yanaihara N, Caplen N, Bowman E, Seike M, Kumamoto K, Yi M, Stephens RM, Okamoto A, Yokota J, Tanaka T. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis. Cancer Cell. 2006;9:189-198. [PubMed] [DOI] |
| 8. | Bruchova-Votavova H, Yoon D, Prchal JT. miR-451 enhances erythroid differentiation in K562 cells. Leuk Lymphoma. 2010;51:686-693. [PubMed] [DOI] |
| 9. | Zhang Z, Chang H, Li Y, Zhang T, Zou J, Zheng X, Wu J. MicroRNAs: potential regulators involved in human anencephaly. Int J Biochem Cell Biol. 2010;42:367-374. [PubMed] [DOI] |
| 10. | Bandres E, Bitarte N, Arias F, Agorreta J, Fortes P, Agirre X, Zarate R, Diaz-Gonzalez JA, Ramirez N, Sola JJ. microRNA-451 regulates macrophage migration inhibitory factor production and proliferation of gastrointestinal cancer cells. Clin Cancer Res. 2009;15:2281-2290. [PubMed] [DOI] |
| 11. | Nan Y, Han L, Zhang A, Wang G, Jia Z, Yang Y, Yue X, Pu P, Zhong Y, Kang C. MiRNA-451 plays a role as tumor suppressor in human glioma cells. Brain Res. 2010;1359:14-21. [PubMed] [DOI] |
| 12. | Lue H, Kleemann R, Calandra T, Roger T, Bernhagen J. Macrophage migration inhibitory factor (MIF): mechanisms of action and role in disease. Microbes Infect. 2002;4:449-460. [PubMed] [DOI] |
| 13. | Kamimura A, Kamachi M, Nishihira J, Ogura S, Isobe H, Dosaka-Akita H, Ogata A, Shindoh M, Ohbuchi T, Kawakami Y. Intracellular distribution of macrophage migration inhibitory factor predicts the prognosis of patients with adenocarcinoma of the lung. Cancer. 2000;89:334-341. [PubMed] [DOI] |
| 14. | Ren Y, Tsui HT, Poon RT, Ng IO, Li Z, Chen Y, Jiang G, Lau C, Yu WC, Bacher M. Macrophage migration inhibitory factor: roles in regulating tumor cell migration and expression of angiogenic factors in hepatocellular carcinoma. Int J Cancer. 2003;107:22-29. [PubMed] [DOI] |
| 15. | Gregory RI, Shiekhattar R. MicroRNA biogenesis and cancer. Cancer Res. 2005;65:3509-3512. [PubMed] [DOI] |
| 16. | How I manage my difficult problems. Aust Fam Physician. 1991;20:365-448. [PubMed] |
| 18. | Bitarte N, Bandres E, Boni V, Zarate R, Rodriguez J, Gonzalez-Huarriz M, Lopez I, Javier Sola J, Alonso MM, Fortes P. MicroRNA-451 is involved in the self-renewal, tumorigenicity, and chemoresistance of colorectal cancer stem cells. Stem Cells. 2011;29:1661-1671. [PubMed] [DOI] |
| 19. | Calandra T, Roger T. Macrophage migration inhibitory factor: a regulator of innate immunity. Nat Rev Immunol. 2003;3:791-800. [PubMed] [DOI] |
| 20. | Flaster H, Bernhagen J, Calandra T, Bucala R. The macrophage migration inhibitory factor-glucocorticoid dyad: regulation of inflammation and immunity. Mol Endocrinol. 2007;21:1267-1280. [PubMed] [DOI] |
| 21. | Kyriakis JM. Thinking outside the box about Ras. J Biol Chem. 2009;284:10993-10994. [PubMed] [DOI] |
| 22. | Murakami M, Suzuki H, Nakamoto H, Kageyama Y, Naitoh M, Sakamaki Y, Saruta T. Calcitonin gene-related peptide modulates adrenal hormones in conscious dogs. Acta Endocrinol (Copenh). 1991;124:346-352. [PubMed] |
| 23. | Han I, Lee MR, Nam KW, Oh JH, Moon KC, Kim HS. Expression of macrophage migration inhibitory factor relates to survival in high-grade osteosarcoma. Clin Orthop Relat Res. 2008;466:2107-2113. [PubMed] [DOI] |
| 24. | Amin MA, Volpert OV, Woods JM, Kumar P, Harlow LA, Koch AE. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 2003;93:321-329. [PubMed] [DOI] |
| 25. | Li Z, Ren Y, Wu QC, Lin SX, Liang YJ, Liang HZ. Macrophage migration inhibitory factor enhances neoplastic cell invasion by inducing the expression of matrix metalloproteinase 9 and interleukin-8 in nasopharyngeal carcinoma cell lines. Chin Med J (Engl). 2004;117:107-114. [PubMed] |
| 26. | Meyer-Siegler KL, Iczkowski KA, Leng L, Bucala R, Vera PL. Inhibition of macrophage migration inhibitory factor or its receptor (CD74) attenuates growth and invasion of DU-145 prostate cancer cells. J Immunol. 2006;177:8730-8739. [PubMed] |
| 27. | Zheng YX, Yang M, Rong TT, Yuan XL, Ma YH, Wang ZH, Shen LS, Cui L. CD74 and macrophage migration inhibitory factor as therapeutic targets in gastric cancer. World J Gastroenterol. 2012;18:2253-2261. [PubMed] [DOI] |
| 28. | Tomiyasu M, Yoshino I, Suemitsu R, Okamoto T, Sugimachi K. Quantification of macrophage migration inhibitory factor mRNA expression in non-small cell lung cancer tissues and its clinical significance. Clin Cancer Res. 2002;8:3755-3760. [PubMed] |
| 29. | Rendon BE, Roger T, Teneng I, Zhao M, Al-Abed Y, Calandra T, Mitchell RA. Regulation of human lung adenocarcinoma cell migration and invasion by macrophage migration inhibitory factor. J Biol Chem. 2007;282:29910-29918. [PubMed] [DOI] |
| 30. | Shun CT, Lin JT, Huang SP, Lin MT, Wu MS. Expression of macrophage migration inhibitory factor is associated with enhanced angiogenesis and advanced stage in gastric carcinomas. World J Gastroenterol. 2005;11:3767-3771. [PubMed] |
| 31. | Lee H, Rhee H, Kang HJ, Kim HS, Min BS, Kim NK, Kim H. Macrophage migration inhibitory factor may be used as an early diagnostic marker in colorectal carcinomas. Am J Clin Pathol. 2008;129:772-779. [PubMed] [DOI] |