修回日期: 2012-06-12
接受日期: 2012-06-29
在线出版日期: 2012-07-28
目的: 探讨鸟苷酸环化酶C(GC-C)基因沉默对人胃癌裸鼠皮下种植瘤的影响及其机制.
方法: 将SGC-7901细胞(SGC-7901组)、空质粒转染的细胞(PRNA组)、GC-C基因稳定沉默的细胞(GC-C-shRNA组)悬液先在裸鼠皮下接种成瘤, 再取瘤组织块分别接种到裸鼠皮下, 建立3种胃癌裸鼠皮下种植瘤模型. 观察裸鼠一般情况、肿瘤的成瘤率、生长速度, 描绘肿瘤的生长曲线, 计算肿瘤的抑瘤率; 采用实时荧光定量PCR(RFQ-PCR), Western blot和免疫组织化学法检测GC-C和趋化因子受体4(CXCR4)在各组移植瘤组织中的表达.
结果: 与SGC-7901组和PRNA组比较, GC-C-shRNA组裸鼠移植瘤生长速度明显减慢、体积明显变小(抑制率分别为33.7%、33.2%), 肿瘤异型性、坏死程度明显降低, 差异具有统计学意义(均P<0.05), 且移植瘤组织中GC-C和CXCR4 mRNA和蛋白均明显下调(GC-C mRNA: 7.47±1.70 vs 11.18±0.60, 11.28±0.85; GC-C蛋白: 0.52±0.15 vs 1.04±0.19, 1.03±0.24; CXCR4蛋白: 0.67±0.13 vs 1.02±0.21, 1.03±0.23, 均P<0.05).
结论: GC-C基因稳定沉默在体内能保持稳定, 且能抑制裸鼠移植瘤生长, 该过程可能与CXCR4下调有关.
引文著录: 孟海, 张健锋, 毛振彪, 薛世民, 吴信华, 鞠少卿. 鸟苷酸环化酶C基因沉默对人胃癌裸鼠皮下种植瘤的影响. 世界华人消化杂志 2012; 20(21): 1919-1926
Revised: June 12, 2012
Accepted: June 29, 2012
Published online: July 28, 2012
AIM: To study the effect of GC-C gene silencing on the biological behaviors of subcutaneously implanted gastric tumors and to explore the possible mechanisms involved.
METHODS: Non-transfected SGC-7901 cells (SGC-7901 group), SGC-7901 cells transfected cell with an empty plasmid (PRNA group), and those transfected with a shRNA targeting the GC-C gene (GC-C-shRNA group) were subcutaneously inoculated into nude mice. Then, the histologically intact xenograft tissues were subcutaneously transplanted to nude mice to observe the condition of nude mice and determine the rate of tumor survival and growth velocity. The levels of GC-C mRNA and protein were determined by RFQ-PCR and Western blot, respectively. The heteromorphism and necrosis of tumor cells were observed after HE staining. The expression of CXCR4 protein was detected by Western blot and immunohistochemistry.
RESULTS: The rate of tumor survival and the condition of nude mice did not differ significantly among the three groups. Compared to the SGC-7901 group and PRNA group, the tumors grew more slowly and became smaller in the GC-C-shRNA group (all P < 0.05). The reduced rate of tumor growth velocity and volume in the GC-C-shRNA group were 33.7% and 33.2%, respectively, and GC-C gene silencing efficiency was 66.8% and 64.4%, respectively (P < 0.05). The expression of GC-C protein decreased by 50.0% and 49.6%, respectively (P < 0.05), and the degree of tumor heteromorphism and necrosis and expression of CXCR4 protein in the GC-C-shRNA group decreased obviously (all P < 0.05).
CONCLUSION: GC-C gene silencing slows the growth velocity of gastric tumors in vivo possibly in a CXCR4-dependent manner.
- Citation: Meng H, Zhang JF, Mao ZB, Xue SM, Wu XH, Ju SQ. GC-C gene silencing inhibits the growth of subcutaneously implanted gastric tumors in nude mice. Shijie Huaren Xiaohua Zazhi 2012; 20(21): 1919-1926
- URL: https://www.wjgnet.com/1009-3079/full/v20/i21/1919.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i21.1919
胃癌(gastric cancer, GC)是消化系统最常见的恶性肿瘤, 我国每年胃癌新发病例占全部恶性肿瘤的17%以上, 死亡率占全部恶性肿瘤的20%以上[1]. 该病因缺乏特异性的初筛指标以及早期症状不明显, 大多数患者在就诊时已经处于进展期. 传统手术及放化疗对进展期胃癌的疗效仍不理想, 研究表明, 早期胃癌术后5年生存率可达90%以上[2], 但在我国胃癌的早期诊断率很低(<10%)[3], 进展期胃癌疗术后5年生存率仅有30%-40%. Correa[4]提出的正常胃黏膜→浅表性胃炎→萎缩性胃炎→肠上皮化生→异型增生→肠型胃癌是目前较为普遍接受的观点. 肠上皮化生和异型增生被认为是胃癌癌前病变. 胃癌发生、发展的过程涉及遗传学和表观遗传学[5]. 鸟苷酸环化酶C(guanylyl cyclase C, GC-C)正常组织中仅存在于肠黏膜细胞, 而不在正常胃黏膜中表达. 但在肠上皮化生、异型增生到胃癌过程中, 胃黏膜出现GC-C异位表达的现象.
趋化因子(chemokines)过去认为是一类控制细胞向炎症定向迁移的细胞因子, 目前研究发现趋化因子与肿瘤发生也密切相关, 肿瘤细胞在生长过程中能够分泌多种趋化因子并且表达其受体, 进而刺激肿瘤细胞生长. Singh等[6]研究发现趋化因子受体4(chemokine receptor 4, CXCR4)及其配体CXCL12与肿瘤转移关系密切. 孙梯业等[7]研究认为CXCR4和VEGF-C的表达水平与胃癌密切相关, 并与患者的组织学类型、分化程度、肿瘤浸润深度和淋巴结转移等有相关性. 前期我们建立稳定干扰GC-C基因的细胞模型[8], 通过基因芯片技术筛选出差异基因表达谱变化, 本实验通过建立人胃癌裸鼠皮下种植瘤模型, 利用生长曲线、HE染色、定量PCR(RFQ-PCR)、Western blot、免疫组织化学染色研究GC-C基因沉默对肿瘤生物学行为的影响, 同时选择具有明显差异表达的CXCR4在体内进一步验证, 旨在探讨GC-C基因在人胃癌发生发展中的作用机制, 为胃癌的预防和治疗提供新思路和方法.
裸鼠(Balb/c/nu/nu)购自上海西普尔-必凯实验动物有限公司, 代养于南通大学实验动物中心无特殊致病原(special pathogen free, SPF)屏障环境. 雌雄兼用, 5-6 wk, 体质量17 g±2.5 g, 分笼饲养(每笼3只). 实验过程中裸鼠均饲养在SPF屏障环境内. 肿瘤种植前1 wk购入裸鼠, 使之适应新环境. SGC-7901细胞系购自中科院上海细胞所; DMEM培养基(高糖)为Invitrogen公司产品; 胎牛血清购自杭州四季青公司; 0.25%胰酶、BCA蛋白浓度测定试剂盒、细胞裂解液、G418抗生素、PMSF、Glycine、SDS-PAGE凝胶试剂盒、SDS-PAGE上样缓冲液、PVDF膜、ECL化学发光剂、显影定影试剂盒和Tris等均为碧云天公司产品; RISOTM RNA提取试剂和EzOmics one-step qPCR购自mix Biomics公司; GC-C抗体、Tublin抗体购自Santa Cruz公司; CXCR4抗体购自ABCAM公司; HRP标记山羊抗小鼠IgG购自博士德公司; 纤维连接蛋白购自BD公司; 荧光定量PCR试剂盒购自宝生物工程有限公司; DEPC为上海捷瑞公司产品.
1.2.1 细胞培养: SGC-7901细胞用DMEM高糖培养基培养; 空载体组及GC-C基因沉默组细胞用含G418(浓度为200 mg/L)的DMEM高糖培养基培养. 细胞复苏后, 当细胞生长1-2 d, 弃细胞培养上清, 用PBS润洗细胞2-3次, 重新加入适量含100 mL/L FBS的DMEM高糖培养基, 将瓶盖旋松1/4圈, 37 ℃、50 mL/L CO2恒温培养箱中培养. 弃细胞培养上清, 用PBS润洗细胞2-3次. 加入适量0.25%胰蛋白酶, 37 ℃消化5-10 min至所有细胞变圆, 露出细胞间隙时终止反应, 将消化下来的细胞用滴管轻轻吹打成单细胞悬液. 将瓶盖旋松1/4圈, 37 ℃、50 mL/L CO2恒温培养箱中培养.
1.2.2 分组及造模: 将18只裸鼠随机分为3组, 每组6只, 即A: SGC-7901组; B: 空载体组(PRNA组); C: GC-C基因沉默组(GC-C-shRNA组). 将处于生长对数期的SGC-7901细胞、空质粒转染的细胞株、GC-C基因沉默的细胞株分别用0.25%的胰蛋白酶消化使细胞脱壁、分散, 用无血清培养液离心洗涤2次, 计数活细胞数, 将细胞悬于PBS中, 制成单细胞悬液, 调整细胞浓度至1×108/mL. 无菌条件下, 用l mL注射器将3种肿瘤细胞分别接种于3组裸鼠右侧腋部皮下, 接种量为每只0.1 mL(含107个活细胞), 每组接种6只. 待肿瘤在皮下生长到约1 cm3大小, 皮下传代1次. 脱颈处死裸鼠, 并用75%乙醇浸泡消毒5 min. 无菌操作解剖裸鼠, 完整取出皮下肿瘤, 去除坏死部分, 选取鱼肉状组织置于生理盐水中, 剪成直径1-2 mm瘤块备用. 用18号套管针吸取1-2块瘤组织接种于裸鼠前侧腋下, 每周观察裸鼠2-3次, 记录裸鼠的全身状况、饮食、运动情况. 每周测量1次肿瘤的长径(a)、短径(b)并记录, 根据V = 1/2ab2求出体积.
标本的采集: 当荷瘤鼠生长到7 wk时, 脱颈处死裸鼠取肿瘤, 肿瘤称质量计算抑瘤率. 所取标本部分迅速放进-80 ℃冰箱冷冻保存待检, 部分以10%甲醛固定. 描绘肿瘤的生长曲线, 计算抑瘤率: 抑瘤率 = (对照组瘤质量-实验组瘤质量)/对照组瘤重×100%. 进行HE染色光镜观察摄片.
1.2.3 实时荧光定量PCR检测GC-C mRNA的表达: 从GeneBank查取基因序列, 以Primer 5.0设计软件分别设计GC-C、β-actin引物各1对, 其序列及扩增片段大小分别为: GC-C-F: CAACCTGACCAGTTCTACGG, GC-C-R: AATGTGCCATCAGGGTAGGA; β-actin-F: TGACGTG GACATCCGCAAAG, β-actin-R: CTGGAAGGTGGACAGCGAGG. 上述引物均由上海博彩生物科技有限公司合成. 称取从-80 ℃冰箱中取出解冻后的肿瘤组织60-100 mg, 置入无菌匀浆器中, 加入1 mL TRIzol, 室温下充分匀浆后倒入1.5 mL离心管, 静置5 min; 加入0.2 mL氯仿, 振荡15 s, 室温静置10 min; 4 ℃ 12 000 r/min×15 min条件下离心后, 取上清液至另1个1.5 mL离心管; 加入0.5 mL异丙醇, 将管中液体轻轻混匀, 室温静置10 min; 4 ℃ 12 000 r/min×10 min条件下离心后弃上清; 加入1 mL 4 ℃预冷过的75%乙醇, 轻轻洗涤沉淀, 4 ℃ 7 500 r/min×5 min, 弃上清, 同法再洗1遍; 开盖室温晾干后, 加入适量DEPC水溶解(可65 ℃促溶15 min).
反转录反应条件如下: 37 ℃ 15 min, 85 ℃ 5 s(反转录酶失活反应). 实时荧光定量PCR反应体系: SYBR Premix Ex TaqTM 12.5 μL, PCR Forward Primer 1.0 μL, PCR Reverse Primer 1.0 μL, 模板(cDNA溶液)2.0 μL, 无菌双蒸水8.5 μL, 总体积25 μL. PCR扩增程序: 95 ℃预变性30 s; 95 ℃ 5 s, 72 ℃ 30 s. GC-C的沉默效率 = (1-R)×100%, R(GC-C mRNA的相对表达量) = 2-∆∆Ct = 2-[Ct(目样-目管)-Ct(对样-对管)].
1.2.4 Western blot检测GC-C和CXCR4蛋白表达: 从-80 ℃取出组织, 按100 g/L加入蛋白裂解液, 剪碎, 将离心管放冰水混合液中使组织复温30 min; 冰浴匀浆, 将组织打碎; 冰浴静置30 min后在4 ℃ 12 000 r/min离心20 min, 取上清分装于0.5 mL离心管中, 用紫外分光光度仪测定蛋白质的含量, -80 ℃保存. SDS-PAGE凝胶电泳过程: GC-C用8%分离胶, CXCR4用10%分离胶; 电泳时的电压及时间GC-C积层胶100 V 30 min, 分离胶130 V 90 min; CXCR4积层胶80 V 30 min, 分离胶120 V 60 min. 350 mA 150 min恒流转膜至PVDF膜, 5%脱脂牛奶4 ℃摇床封闭过夜, TBST洗膜5 min后, 加入5%脱脂牛奶稀释的一抗(GC-C为1:200, CXCR4为1:400), 置4 ℃摇床24-72 h; 加入辣根过氧化物酶标记二抗(1:5 000), 室温放置2 h(β-actin一抗为1:2 000, 二抗为1:1 000). TBST洗膜5 min×6次; 化学增强发光剂ECL显影、定影, 室温下晾干后扫描, 用图像处理系统分析目标带.
1.2.5 免疫组织化学染色(En Vision两步法): 固定、脱水、透明、浸蜡、包埋、切片、脱蜡和水化. 抗原修复后磷酸盐缓冲液(PBS)洗涤2次; 每张切片加1滴3%过氧化酶阻断溶液, 室温下孵育10 min, 以阻断内源性过氧化物酶的活性; PBS冲洗3次, 每次5 min; 除去PBS液, 每张切片加1滴正常非免疫动物血清, 室温下孵育30 min; 除去血清, 每张切片分别加1滴羊抗兔GCC多克隆抗体(工作浓度1:100)或羊抗兔CXCR4多克隆抗体(工作浓度1:50), 室温作用60 min; PBS冲洗3次, 每次5 min; 除去PBS液, 每张切片加1滴生物素标记的二抗, 室温下孵育45 min; PBS冲洗3次, 每次5 min; 除去PBS液, 每张切片加2滴新鲜配制的3,3'-二氨基联苯胺(DAB)溶液显色, 显色时间8 min; 自来水冲洗10 min. 苏木素复染2 min, 置于盐酸酒精分化; 自来水冲洗10 min; 2次无水酒精脱水干燥, 二甲苯透明, 干燥后中性树胶封片, 光镜观察摄片.
结果根据染色阳性细胞数和染色强度综合评定, 阳性细胞均为胞浆中出现黄色至棕褐色颗粒. 染色细胞参照邢传平等[9]的标准, 阳性染色细胞数以4级分法, 即阳性细胞≤25%为(+), 26%-50%为(++), >50%为(+++), 无阳性细胞为(-), 分别记为1、2、3、0分; 染色强度: 浅黄色为(+), 棕黄色为(++), 棕褐色为(+++), 无着色为(-), 分别记为1、2、3、0分. 二者分数相加, 总分1-2分计为弱阳性(+), 3-4分为阳性(++), 5-6分为强阳性(+++), 0分阴性(-). 先在低倍镜下(×100)选择有代表性的区域, 随机观察5个视野, 计算阳性细胞数的平均百分数作为该切片的阳性细胞百分比进行分级, 染色强度以多数阳性细胞呈现的染色特征为标准. 判断时摒除非特异性着色和背景着色. 切片结果均经2名经验丰富的病理科医生进行诊断.
统计学处理 所有数据用SPSS11.5统计软件进行分析, 数据资料用mean±SD表示, 采用t检验、方差分析进行统计学处理. P<0.05表示差异有统计学意义.
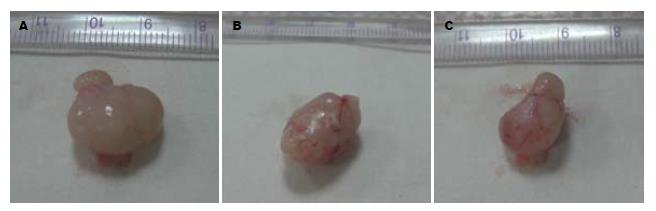
SGC7901组、PRNA组6只均成瘤, 成瘤率100%(6/6); GC-C-shRNA组5只成瘤, 成瘤率83.3%(5/6), 3组之间成瘤率无明显差异. 3组裸鼠的饮食、活动情况及精神状态均正常, 无明显差异(图1).
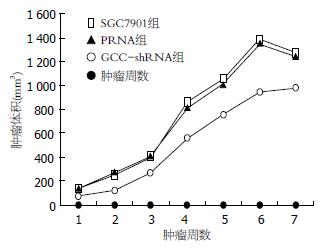
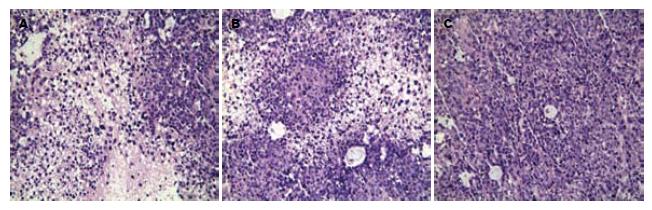
肿瘤体积的变化如表1. 肿瘤质量的变化SGC7901组、PRNA组和GC-C-shRNA组依次为: 1 073.3 mg±16.4 mg、1 064.5 mg±17.4 mg、711.6 mg±19.7 mg. 根据肿瘤体积绘制肿瘤生长曲线图(图2). 结果提示, GC-C-shRNA组较SGC7901组和PRNA组肿瘤的体积和质量均明显减小, 生长速度减缓. HE染色提示, SGC7901组和PRNA组均可见大片细胞坏死, 异型性明显, 核分裂相多见; 而GC-C-shRNA组仅见少量坏死, 异型性较低, 核分裂相少见(图3).
实时荧光定量PCR检测3组肿瘤GC-C mRNA的表达, 结果提示GC-C-shRNA组(7.47±1.70)较SGC7901组(11.18±0.60)和PRNA组(11.28±0.85)明显降低, 差异具有统计学意义(P<0.05); 而SGC7901组与PRNA组之间无明显差异(P>0.05). GC-C的沉默效率为64.4%.
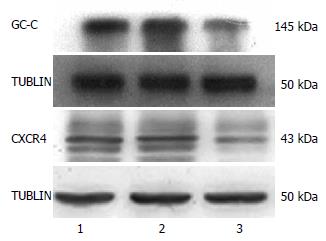
GC-C-shRNA组的GC-C蛋白相对表达量(0.52±0.15)明显低于SGC7901组(1.04±0.19)和PRNA组(1.03±0.24), 差异具有统计学意义(P<0.05); 而SGC7901组与PRNA组比较无明显差异(P>0.05). GC-C蛋白的沉默效率为50.0%. GC-C-shRNA组的CXCR4蛋白表达量(0.67±0.13)亦明显低于SGC7901组(1.02±0.21)和PRNA组(1.03±0.23), 差异具有统计学意义(P<0.05). SGC7901组与PRNA组比较, 两者之间无明显差异(P>0.05, 图4).
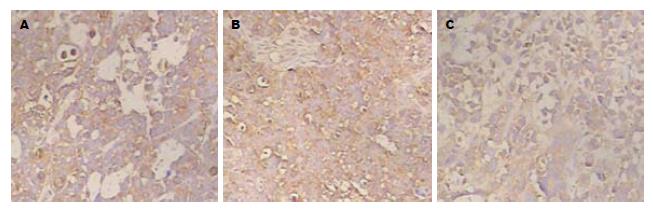
GC-C-shRNA组CXCR4蛋白阳性细胞表达率及强度与SGC7901组、PRNA组相比明显降低, 用秩变换方差分析发现差异具有显著性(P<0.05); SGC7901组与PRNA组相比, CXCR4蛋白阳性细胞表达率及强度无明显差异(P>0.05, 图5).
鸟苷酸环化酶(guanylyl cyclase, GC)家族具有催化GTP形成环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)的作用, 可分为膜结合型和胞浆可溶型2种亚型. GC受体在哺乳动物组织中表达, 家族有7个成员, 即GC-A--GC-G, 其中GC-C基因定位于人类12号染色体. GC-C[10-12]通过与配体激活, 使细胞内cGMP升高, 进而直接激活cGMP依赖的信号通路. Park等[13]和Birbe等[14]研究表明所有肠型异型增生和肠型胃癌均表达GC-C, 而正常胃黏膜不表达GC-C. 研究还发现, 胃腺癌组织GC-C异位表达与CDX2对其激活有关[15,16]. 近年来Debruyne等[17]研究证明, 胆汁酸可以通过NF-κB及CDX-2途径使GC-C在食管细胞肠化生中异位表达. 最近Mao等[18]研究表明GC-C基因在胃癌SGC-7901细胞中高表达, 靶向GC-C基因的siRNA可以有效抑制人胃癌细胞株SGC-7901生长, 促进凋亡, 并抑制癌细胞的侵袭和转移能力, 提示GC-C基因与胃腺癌的发生、发展有密切关系. 因此认为GC-C可能是一潜在的癌基因, 在胃腺癌发生、发展过程中发挥重要作用.
近来研究显示转移性结直肠癌细胞中, GC-C表达是正常肠上皮细胞的2-10倍[19,20]. 毛振彪等[16]研究30例胃癌样本, 结果发现, GC-C mRNA及蛋白的阳性率分别为20/30和19/30, 且肠型胃癌较弥漫型胃癌阳性率高(P<0.05), 并通过RNA干扰人SGC-7901细胞株GC-C基因表达, 发现GC-C基因抑制后SGC-7901细胞株的增殖、迁移、黏附、侵袭力降低, 细胞凋亡增加. 我们前期[16,18]检测发现GC-C在肠上皮化生组织中表达率为39.1%, 异型增生组织为55.6%, 胃癌组织为56.7%, 而远癌胃组织中不表达, 靶向GC-C基因的siRNA瞬间转染肿瘤细胞可以抑制肿瘤生长和促进其凋亡. 进一步发现, 胃癌组织中GC-C表达与其内生性配体鸟苷素的表达和幽门螺杆菌(Helicobacter pylori, H. pylori)感染正相关, 推测H. pylori感染导致胃酸分泌减少, pH值上升, 诱发GN基因表达上调, 在HNF-4、CDX2、GATA-4和NF-IL6等转录因子共同作用下, 激活GC-C基因异位表达参与肠型胃癌的发生[21]. 因此, 提示GC-C基因在胃癌发生发展中具有重要作用.
本研究中, 3组裸鼠活动自如, 饮食及精神状态正常, 成瘤率无明显差异. 与SGC7901组、PRNA组相比, GC-C-shRNA组肿瘤生长速度和体积均明显变小(P<0.05); HE染色显示, GC-C-shRNA组肿瘤仅见少量坏死, 异型性较低, 核分裂相少见, 这一结果表明GC-C基因沉默可明显抑制肿瘤生长, 减低胃腺癌细胞的异型性及恶性程度. GC-C mRNA和蛋白的沉默效率分别为64.4%和50.0%(P<0.05), 这一结果表明GC-C基因沉默在人胃癌裸鼠种植瘤内能保持相对稳定. GC-C基因沉默对于胃腺癌的治疗可能具有重要的作用.
趋化因子是一类控制细胞向炎症定向迁移的细胞因子, 目前研究发现其与肿瘤的发生亦密切相关, 肿瘤细胞在生长过程中能够自主分泌多种趋化因子并且表达其受体, 促进肿瘤细胞生长. CXCR4是趋化因子SDF-1(stromal cell derived factor-1)受体, 为编码352个氨基酸且高度保守的G蛋白耦联受体, 是组织表达最为广泛的细胞因子受体之一, 在多种恶性肿瘤细胞的生长、播散和器官特异性转移中都有很重要的作用. Kryczek等[22]提出, CXCL12和CXCR4构成的生物轴可能在包括乳腺癌在内的多种实体瘤的生长、转移中发挥重要作用, 与恶性肿瘤的发生、发展及预后密切相关. Yasumoto等[23]研究发现, 胃癌细胞系NUGC4中CXCR4 mRNA呈高丰度转录.
CXCR4指引着不同类型干细胞的趋化迁移, 其功能有: (1)造血干细胞归巢, 骨髓基质细胞分泌SDF-1, 趋化CXCR4阳性的造血干细胞的归巢; (2)胚胎发育, 胚胎发育期间组织干细胞在SDF-1-CXCR4引领下定位于相应的组织器官, 进而分化发育成熟. CXCL12是CXC趋化因子亚家族的成员之一, 他的趋化作用是由趋化因子受体CXCR4调节, 是已知CXCR4的惟一配体, 两者之间结合具有专属性[24]. Scotton等[25]报道在上皮性卵巢癌中筛选14种趋化因子受体, 结果仅CXCR4在卵巢癌中表达, 同时在卵巢癌患者的腹水中检测出其配体CXCL12, 证实了CXCL12可以促进卵巢癌细胞生长、趋化、侵袭, 阐明了CXCL12-CXCR4在卵巢癌的腹膜转移中具有重要作用. Oonakahara等[26]报道CXCL12-CXCR4轴在非小细胞肺癌的胸膜腔播散中亦发挥重要作用. Brand等[27]研究表明, CXCR4表达与胃癌分期、分化程度及淋巴结转移呈正相关, CXCR4在胃癌组织中的表达随胃癌细胞分化程度上升而下降, 随胃癌临床分期进展而上升. 推测CXCR4与其配体CXCL12结合后能抑制胃癌细胞分化, 促进胃癌生长及转移. Luo等[28]报道应用趋化因子受体拮抗剂, 抑制趋化因子受体与其配体结合, 可抑制肿瘤生长及转移. Woo等[29]检测107例胃癌患者血清中CXCL12和VEGF浓度, 结果发现胃癌患者血清CXCL12和VEGF浓度均高于对照组, CXCL12与胃癌远处转移及血管内皮生长因子(vascular endothelial growth factor, VEGF)水平呈正相关, 推测CXCL12、VEGF可能在胃癌新生血管形成及肿瘤转移过程中发挥着协同作用. 马向涛等[30]应用Western blot法检测40例胃癌组织中CXCL12/CXCR4的表达, 结果显示胃癌组织中CXCL12/CXCR4表达水平明显高于正常胃黏膜(P<0.05), 32例淋巴结转移癌组织中CXCL12/CXCR4蛋白表达高于原发癌, 表明CXCL12/CXCR4可能在胃癌淋巴结转移过程中发挥重要作用.
胃癌细胞生长的原因可能与以下几个因素有关: (1)CXCL12与配体SDF-1结合导致G蛋白结构改变, 激活MAPK、ERK1/2和SAPK/JNK通路等. 目前研究发现SDF-1激活ERK-1/2和Akt信号通路, 降解胶原纤维, 破坏基底膜, 减少肿瘤细胞的凋亡, 促进细胞增殖[27]; (2)SDF-1增加肿瘤细胞内增殖细胞核抗原的同时, 下调裂解的caspase-3并抑制凋亡[31]; (3)促进新生血管形成, 是促进肿瘤细胞增殖和生长的主要因素之一[32]; (4)CXCL12能促进胃癌细胞生成和分泌基质金属蛋白酶9(matrix metalloproteinases, MMP9), 使肿瘤细胞易于跨膜迁移, 促进VEGF的分泌, 促进肿瘤细胞穿过血管基底膜, 导致肿瘤细胞侵袭力增强[33].
本研究检测3组肿瘤CXCR4蛋白表达, Western blot法检测显示, GC-C-shRNA组与SGC-7901组、PRNA组相比, CXCR4蛋白表达明显降低; 免疫组织化学方法检测显示, GC-C-shRNA组CXCR4蛋白阳性细胞表达率及强度明显低于SGC-7901组和PRNA组(P<0.05). 推测GC-C基因可能通过上调CXCR4参与胃癌的发生、发展, GC-C与CXCL12-CXCR4生物轴相互作用可能存在交叉对话(cross-talk), 但具体机制尚不完全清楚, 有待进一步深入探讨.
总之, GC-C基因沉默的胃腺癌细胞生长速度减慢, 异形性及恶性程度降低; GC-C基因可能通过上调CXCR4的表达而影响胃腺癌的生物学行为, 为研究GC-C基因在体内的作用机制提供了新的思路和方法; GC-C基因有望成为胃癌基因治疗的新的分子靶点.
大量研究表明, 鸟苷酸环化酶C(GC-C)、趋化因子受体(CXCR4)高表达能促进肿瘤发生, 但有关GC-C作用机制及两者相关性鲜见报道.
姜相君, 主任医师, 青岛市市立医院消化科
大量研究报道, GC-C、CXCR4在食管癌、胃癌、肝癌等多种恶性肿瘤中高表达, 但对其发生机制仍存在争议, GC-C基因沉默对CXCR4表达及胃癌的影响报道甚少, 需进一步探讨、研究.
鸟苷酸环化酶C(GC-C): 具有催化GTP形成cGMP的作用, 可分为膜结合型和胞浆可溶型2种亚型. GC-C基因定位于人类12号染色体, 正常组织中仅存在于肠黏膜细胞. 但在肠上皮化生、异型增生到胃癌过程中, 胃黏膜出现GC-C异常表达的现象.
GC-C基因沉默的胃腺癌细胞生长速度减慢, 异形性及恶性程度降低, 该基因可能通过上调CXCR4的表达而影响胃腺癌的生物学行为. GC-C基因有望成为胃癌基因治疗的新的分子靶点.
本文探讨GC-C基因沉默对人胃癌裸鼠皮下种植瘤的影响及其机制, 思路清晰, 实验设计合理, 结果可信, 论据可靠.
编辑:张姗姗 电编:鲁亚静
| 1. | Yang L. Incidence and mortality of gastric cancer in China. World J Gastroenterol. 2006;12:17-20. [PubMed] |
| 2. | Yuasa N, Nimura Y. Survival after surgical treatment of early gastric cancer, surgical techniques, and long-term survival. Langenbecks Arch Surg. 2005;390:286-293. [PubMed] [DOI] |
| 4. | Correa P. A human model of gastric carcinogenesis. Cancer Res. 1988;48:3554-3560. [PubMed] |
| 6. | Singh S, Sadanandam A, Singh RK. Chemokines in tumor angiogenesis and metastasis. Cancer Metastasis Rev. 2007;26:453-467. [PubMed] [DOI] |
| 10. | Kaupp UB, Seifert R. Cyclic nucleotide-gated ion channels. Physiol Rev. 2002;82:769-824. [PubMed] |
| 11. | Münzel T, Feil R, Mülsch A, Lohmann SM, Hofmann F, Walter U. Physiology and pathophysiology of vascular signaling controlled by guanosine 3',5'-cyclic monophosphate-dependent protein kinase [corrected]. Circulation. 2003;108:2172-2183. [PubMed] |
| 12. | Rybalkin SD, Yan C, Bornfeldt KE, Beavo JA. Cyclic GMP phosphodiesterases and regulation of smooth muscle function. Circ Res. 2003;93:280-291. [PubMed] [DOI] |
| 13. | Park J, Schulz S, Haaf J, Kairys JC, Waldman SA. Ectopic expression of guanylyl cyclase C in adenocarcinomas of the esophagus and stomach. Cancer Epidemiol Biomarkers Prev. 2002;11:739-744. [PubMed] |
| 14. | Birbe R, Palazzo JP, Walters R, Weinberg D, Schulz S, Waldman SA. Guanylyl cyclase C is a marker of intestinal metaplasia, dysplasia, and adenocarcinoma of the gastrointestinal tract. Hum Pathol. 2005;36:170-179. [PubMed] [DOI] |
| 15. | Park J, Schulz S, Waldman SA. Intestine-specific activity of the human guanylyl cyclase C promoter is regulated by Cdx2. Gastroenterology. 2000;119:89-96. [PubMed] [DOI] |
| 16. | 毛 振彪, 许 钟, 张 健锋, 朱 慧君, 章 建国, 潘 正平. 鸟苷酸环化酶C和尾型同源盒转录因子2在胃癌及癌前病变组织中的表达及意义. 中华消化杂志. 2008;28:673-677. |
| 17. | Debruyne PR, Witek M, Gong L, Birbe R, Chervoneva I, Jin T, Domon-Cell C, Palazzo JP, Freund JN, Li P. Bile acids induce ectopic expression of intestinal guanylyl cyclase C Through nuclear factor-kappaB and Cdx2 in human esophageal cells. Gastroenterology. 2006;130:1191-1206. [PubMed] [DOI] |
| 18. | Mao ZB, Zhang JF, Xu Z, Zhu HJ, Zhang JG, Pan ZP, Xiao F, Yang JL. Ectopic expression of guanylyl cyclase C in gastric cancer as a potential biomarker and therapeutic target. J Dig Dis. 2009;10:272-285. [PubMed] [DOI] |
| 19. | Schulz S, Hyslop T, Haaf J, Bonaccorso C, Nielsen K, Witek ME, Birbe R, Palazzo J, Weinberg D, Waldman SA. A validated quantitative assay to detect occult micrometastases by reverse transcriptase-polymerase chain reaction of guanylyl cyclase C in patients with colorectal cancer. Clin Cancer Res. 2006;12:4545-4552. [PubMed] [DOI] |
| 20. | Witek ME, Nielsen K, Walters R, Hyslop T, Palazzo J, Schulz S, Waldman SA. The putative tumor suppressor Cdx2 is overexpressed by human colorectal adenocarcinomas. Clin Cancer Res. 2005;11:8549-8556. [PubMed] [DOI] |
| 21. | Zhang JF, Mao ZB, Li ZL, Xue SM, Zhu HJ, Zhang H, Ni RZ. Ectopic expression of guanylyl cyclase C and endogenous ligand guanylin correlates significantly with Helicobacter pylori infection in gastric carcinogenesis. Med Oncol. 2011; Oct 5. [Epub ahead of print]. [PubMed] |
| 22. | Kryczek I, Wei S, Keller E, Liu R, Zou W. Stroma-derived factor (SDF-1/CXCL12) and human tumor pathogenesis. Am J Physiol Cell Physiol. 2007;292:C987-C995. [PubMed] [DOI] |
| 23. | Yasumoto K, Koizumi K, Kawashima A, Saitoh Y, Arita Y, Shinohara K, Minami T, Nakayama T, Sakurai H, Takahashi Y. Role of the CXCL12/CXCR4 axis in peritoneal carcinomatosis of gastric cancer. Cancer Res. 2006;66:2181-2187. [PubMed] [DOI] |
| 24. | Horuk R. Chemokine receptors. Cytokine Growth Factor Rev. 2001;12:313-335. [PubMed] [DOI] |
| 25. | Scotton CJ, Wilson JL, Milliken D, Stamp G, Balkwill FR. Epithelial cancer cell migration: a role for chemokine receptors? Cancer Res. 2001;61:4961-4965. [PubMed] |
| 26. | Oonakahara K, Matsuyama W, Higashimoto I, Kawabata M, Arimura K, Osame M. Stromal-derived factor-1alpha/CXCL12-CXCR 4 axis is involved in the dissemination of NSCLC cells into pleural space. Am J Respir Cell Mol Biol. 2004;30:671-677. [PubMed] [DOI] |
| 27. | Brand S, Dambacher J, Beigel F, Olszak T, Diebold J, Otte JM, Göke B, Eichhorst ST. CXCR4 and CXCL12 are inversely expressed in colorectal cancer cells and modulate cancer cell migration, invasion and MMP-9 activation. Exp Cell Res. 2005;310:117-130. [PubMed] [DOI] |
| 28. | Luo Y, Cai J, Xue H, Miura T, Rao MS. Functional SDF1 alpha/CXCR4 signaling in the developing spinal cord. J Neurochem. 2005;93:452-462. [PubMed] [DOI] |
| 29. | Woo IS, Hong SH, Byun JH, Kang JH, Jeon HM, Choi MG. Circulating stromal cell derived factor-1alpha (SDF-1alpha) is predictive of distant metastasis in gastric carcinoma. Cancer Invest. 2008;26:256-261. [PubMed] [DOI] |
| 30. | 马 向涛, 余 力伟, 王 杉, 杜 如昱, 崔 志荣. 趋化因子受体CXCR4/CXCL12信号转导通路与胃癌淋巴结转移关系的研究. 中国肿瘤临床. 2007;34:544-546, 549. |
| 31. | Kollmar O, Rupertus K, Scheuer C, Junker B, Tilton B, Schilling MK, Menger MD. Stromal cell-derived factor-1 promotes cell migration and tumor growth of colorectal metastasis. Neoplasia. 2007;9:862-870. [PubMed] [DOI] |