修回日期: 2011-06-16
接受日期: 2011-06-21
在线出版日期: 2011-07-08
目的: 探讨缺氧诱导因子-1α(HIF-1α)和上皮细胞间质转化(EMT)相关蛋白在胰腺导管腺癌(PDAC)组织中的表达及临床意义.
方法: 采用免疫组织化学法检测92例PDAC和10例正常胰腺组织中HIF-1α、Snail、Slug、E-cadherin、N-cadherin的表达, 并分析其与患者临床病理特征和预后的关系.
结果: HIF-1α、Snail、Slug、E-cadherin、N-cadherin在PDAC和正常胰腺组织中表达的阳性率分别为: 69.57%, 69.57%, 58.70%, 36.96%, 73.91%; 10%, 0%, 0%, 90%, 0%. HIF-1α的表达与淋巴结转移有关; Snail的表达与TNM分期有关; Slug的表达与TNM分期和淋巴结转移有关; N-cadherin的表达与TNM分期、淋巴结转移和肿瘤分化程度有关. HIF-1α表达与Snail、Slug表达呈正相关(r = 0.309, P = 0.005; r = 0.231, P = 0.027); Snail表达与E-cadherin表达呈负相关(r = -0.223, P = 0.033); E-cadherin表达与N-cadherin表达呈负相关(r = -0.478, P = 0.000). HIF-1α、Snail和E-cadherin是患者术后独立的预后因子.
结论: HIF-1α、Snail、Slug、E-cadherin、N-cadherin在PDAC的演进及预后中发挥作用.
引文著录: 朱光辉, 岑刚, 黄陈, 张志华, 冯正中, 吕秀红, 裘正军. HIF-1α和EMT相关蛋白在胰腺癌组织中的表达及临床意义. 世界华人消化杂志 2011; 19(19): 2022-2030
Revised: June 16, 2011
Accepted: June 21, 2011
Published online: July 8, 2011
AIM: To investigate the expression of hypoxia inducible factor-1α (HIF-1α) and epithelial-mesenchvmal transition (EMT)-related factors in pancreatic ductal adenocarcinoma (PDAC) and to analyze their clinical significance.
METHODS: Immunohistochemistry was used to examine the expression of HIF-1α, Snail, Slug, E-cadherin and N-cadherin in 92 cases of PDAC and 10 cases of normal pancreatic tissue.
RESULTS: The positive expression rates of HIF-1α, Snail, Slug, E-cadherin and N-cadherin were 69.57%, 69.57%, 58.70%, 36.96% and 73.91% in PDAC, and 10%, 0%, 0%, 90% and 0% in normal pancreas tissue. HIF-1α expression was significantly associated with lymph node metastasis. Snail expression was correlated with TNM stage. Slug expression was positively associated with TNM stage and lymph node metastasis. N-cadherin expression was significantly related to TNM stage, lymph node metastasis and histological grade. HIF-1α expression in PDAC was positively correlated with Snail and Slug expression. There was a negative correlation between Snail and E-cadherin expression in PDAC. Expression of E-cadherin was negatively related to that of N-cadherin. Multivariate Cox analysis demonstrated that HIF-1α, Snail and E-cadherin were independent factors for prognosis of PDAC.
CONCLUSION: HIF-1α, Snail, Slug, E-cadherin and N-cadherin play significant roles in the progression and prognosis of PDAC.
- Citation: Zhu GH, Cen G, Huang C, Zhang ZH, Feng ZZ, Lv XH, Qiu ZJ. Clinical significance of expression of HIF-1α and EMT-related factors in pancreatic ductal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(19): 2022-2030
- URL: https://www.wjgnet.com/1009-3079/full/v19/i19/2022.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i19.2022
缺氧是实体瘤微环境的一个重要特征[1], 癌细胞为适应缺氧而发生一系列生物学特性的改变[2]. 缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)在其中发挥重要作用[3], 他与下游靶基因启动子区域的缺氧反应元件(hypoxia responsive element, HRE)结合, 调控其转录[4]. 目前已确定的HIF-1α靶基因大部分参与了转移级联反应过程, 包括上皮细胞间质转型(epithelial-mesenchvmal transition, EMT)、细胞外基质和基底膜降解、肿瘤细胞运动能力增加、新生血管形成等[5]. 我们前期研究证实胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)组织中亦存在HIF-1α过表达, 且其表达与淋巴结转移、临床病理分期有关[6]. EMT指上皮细胞失去上皮细胞的特征而获得间充质细胞的表型[7]. 目前有学者认为他是肿瘤转移的起始事件[8], 其中钙黏素转换和转录因子的表达上调是EMT发生过程中重要的分子事件[9]. 但HIF-1α与EMT相关因子在胰腺癌组织中的表达是否相关及其在胰腺癌演进中的作用还不明确. 因此, 本课题采用免疫组织化学法检测92例PDAC和10例正常胰腺组织中HIF-1α、Snail、Slug、E-钙黏素(epithelia cadherin, E-cadherin)、N-钙黏素(neuronal cadherin, N-cadherin)蛋白的表达, 并统计分析其表达的相关性及与临床病理特征和预后的关系.
收集上海交通大学附属第一人民医院1993-08/2009-12的92例PDAC患者手术切除的胰腺癌标本. 切取供肝附带的胰腺组织10例作为正常胰腺组织标本对照组. 所有标本均经40 g/L中性甲醛固定, 常规石蜡包埋, 连续切片, 厚度4 μm, 行HE染色, 经组织病理学明确诊断. 术前均未接受放、化疗, 按国际抗癌联盟(UICC, 2002版)标准[10]确定胰腺癌TNM分期, 世界卫生组织(WHO, 2000版)[11]标准确定胰腺癌组织学分级. 92例患者中, 男64例, 女28例, 平均年龄(64.73±10.42)岁. 胰头癌79例, 胰体尾癌13例. 组织学分级: 高分化14例, 中分化60例, 低分化16例, 2例分化程度不明; 局部淋巴结: 无淋巴结转移57例, 有淋巴结转移35例; 神经浸润: 无神经浸润42例, 有神经浸润40例, 不明10例; 切缘(镜下): 阴性83例, 阳性9例; TNM分期:Ⅰa期2例, Ⅰb期19例, Ⅱa期37例, Ⅱb期29例, Ⅲ期0例, Ⅳ期5例. 随访截止至2009-12-31, 平均随访时间15.1(1-121) mo. 随访期限从手术后病理确诊为PDAC开始至因复发转移或其他原因死亡或随访终止时间. 至随访截止日期, 57例死亡, 29例存活, 6例失随访, 失访率6.52%. 兔抗人HIF-1α、Snail、Slug多克隆抗体均购自英国Abcam公司、兔抗人E-cadherin、N-cadherin多克隆抗体均购自美国Cell Signaling公司, 超敏SP试剂盒、DAB显色液均购自福州迈新公司.
1.2.1 免疫组织化学SP法: 组织切片, 经脱蜡、枸橼酸盐抗原修复液热修复、过氧化氢、正常羊血清封闭后滴加一抗, HIF-1α(1:50), Snail(1:100), Slug(1:100), E-cadherin(1:25), N-cadherin(1:100). 4 ℃过夜, 复温后滴加二抗, 37 ℃孵育30 min, 滴加辣根过氧化物酶标记的链霉素卵白素工作液, 37 ℃孵育30 min, 最后DAB显色、苏木素复染、封片.
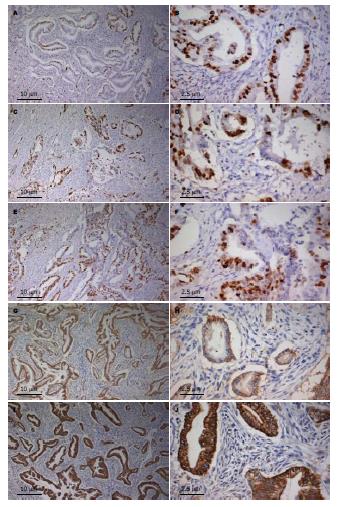
1.2.2 结果判定: 每张切片随机选取10个400倍视野, 每个视野计数100个细胞, 取其均值. HIF-1α评级标准参考[6]. HIF-1α主要位于胞质和胞核, 呈棕黄色到棕褐色. 阳性细胞比例 = 0%, 1%-9%, 10%-50%, >50%, 计分分别为0-3分, 即: -, +, ++, +++. 结果统计时, 分为HIF-1α高表达组(++和+++)和低表达组(-和+). Snail、Slug、E-cadherin、N-cadherin评级标准参考[12]. Snail和Slug主要位于胞核, 呈棕黄色到棕褐色. 阳性细胞比例 = 0%, 1%-49%, 50%-70%, >70%, 分别为-, +, ++, +++. 结果统计时, 将其分为Snail、Slug高表达组(++和+++)和低表达组(-和+). E-cadhein主要位于胞膜和胞质, 呈棕黄色. 按显色细胞比例评分: 阳性细胞比例<10%, 10%-49%, 50%-70%, >70%, 计分分别为0-3分, 即: -, +, ++, +++. 结果统计时, 分为E-cadhein阳性表达组(+, ++和+++)和阴性表达组(-). N-cadhein主要位于胞膜和胞质, 呈棕黄色到棕褐色. 按显色细胞比例评分: 阳性细胞比例 = 0%, 1%-49%, 50%-70%, >70%, 计分分别为0-3分, 即: -, +, ++, +++. 结果统计时, 分为N-cadhein高表达组(++和+++)和低表达组(-和+).
统计学处理 数据采用SPSS13.0统计软件包进行统计分析. 计数资料采用χ2检验或Fisher精确概率法. 双变量非正态分布资料采用Spearman等级相关系数检验. 单因素生存分析采用Kaplan-Meier法和Log-rank检验, 多因素生存分析采用Cox比例风险模型.
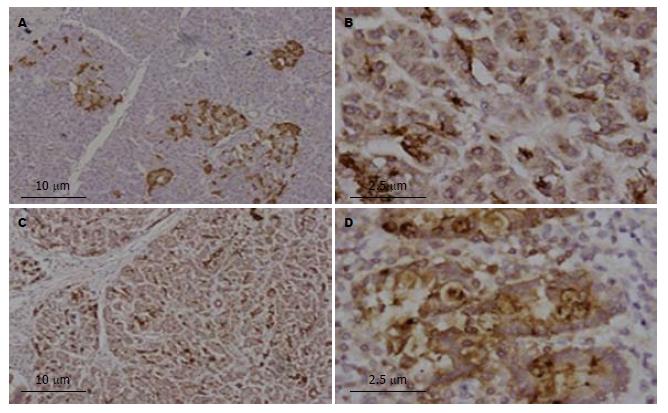
92例胰腺癌组织, HIF-1α、Snail、Slug、E-cadherin、N-cadherin的阳性表达率分别为69.57%(64/92)、69.57% (64/92)、58.70%(54/92)、36.96%(34/92)、73.91%(68/92)(表1, 图1). HIF-1α主要表达在胰腺癌细胞核和胞质, 呈棕黄色到棕褐色, 尤其在具有腺体结构的癌细胞中表达明显; Snail和Slug主要表达在胰腺癌细胞核, 呈棕黄色到棕褐色; E-cadherin和N-cadherin主要表达在胰腺癌细胞膜和胞质, 呈棕黄色. 10例正常胰腺组织中HIF-1α阳性率为10%(1/10), E-cadherin阳性率为90%(9/10), Snail、Slug、N-cadherin均不表达. 1例正常胰腺组织中HIF-1α表达在胰腺细胞胞质, 呈棕黄色. 正常胰腺组织中E-cadherin主要表达在胰腺细胞膜和胞质, 呈棕黄色(图2).
| 蛋白 | 评级(n) | 阳性率(%) | |||
| - | + | ++ | +++ | ||
| HIF-1α | |||||
| PDAC | 28 | 22 | 31 | 11 | 69.57 |
| 对照组 | 0 | 0 | 1 | 0 | 10.00 |
| Snail | |||||
| PDAC | 28 | 14 | 45 | 5 | 69.57 |
| 对照组 | 0 | 0 | 0 | 0 | 0.00 |
| Slug | |||||
| PDAC | 38 | 6 | 36 | 12 | 58.70 |
| 对照组 | 0 | 0 | 0 | 0 | 0.00 |
| E-cadherin | |||||
| PDAC | 58 | 12 | 17 | 5 | 36.96 |
| 对照组 | 1 | 2 | 4 | 3 | 90.00 |
| N-cadherin | |||||
| PDAC | 24 | 18 | 44 | 6 | 73.91 |
| 对照组 | 0 | 0 | 0 | 0 | 0.00 |
胰腺癌中HIF-1α表达与Snail、Slug表达呈正相关(r = 0.309, P = 0.005; r = 0.231, P = 0.027), 即随HIF-1α阳性表达细胞的增多, Snail、Slug阳性表达也随之增多(表2); Snail表达与E-cadherin表达呈负相关(r = -0.223, P = 0.033), 即随着Snail阳性表达细胞的增多, E-cadherin阳性表达随之减少(表3); Slug表达与E-cadherin表达不相关(P = 0.194, 表4); E-cadherin表达与N-cadherin表达呈负相关(r = -0.478, P = 0.000), 即随着E-cadherin阳性表达细胞的减少, N-cadherin的阳性表达随之增多(表5).
| n | HIF-1α | r值 | P值 | ||||
| - | + | ++ | +++ | ||||
| Snail | |||||||
| - | 28 | 11 | 6 | 11 | 0 | 0.309 | 0.005 |
| + | 14 | 1 | 8 | 2 | 3 | ||
| ++ | 45 | 14 | 8 | 18 | 5 | ||
| +++ | 5 | 2 | 0 | 0 | 3 | ||
| n | 28 | 22 | 31 | 11 | |||
| Slug | |||||||
| - | 38 | 18 | 5 | 12 | 3 | 0.231 | 0.027 |
| + | 6 | 0 | 3 | 3 | 0 | ||
| ++ | 36 | 7 | 12 | 14 | 3 | ||
| +++ | 12 | 3 | 2 | 2 | 5 | ||
| n | 28 | 22 | 31 | 11 | |||
| E-cadherin | n | Snail | r值 | P值 | |||
| - | + | ++ | +++ | ||||
| - | 58 | 13 | 12 | 30 | 3 | -0.223 | 0.033 |
| + | 12 | 3 | 0 | 9 | 0 | ||
| ++ | 17 | 8 | 2 | 5 | 2 | ||
| +++ | 5 | 4 | 0 | 1 | 0 | ||
| n | 28 | 14 | 45 | 5 | |||
| E-cadherin | n | Slug | r值 | P值 | |||
| - | + | ++ | +++ | ||||
| - | 58 | 2 | 25 | 30 | 8 | -0.137 | 0.194 |
| + | 12 | 1 | 7 | 9 | 2 | ||
| ++ | 17 | 2 | 3 | 5 | 2 | ||
| +++ | 5 | 1 | 1 | 1 | 0 | ||
| n | 38 | 6 | 36 | 12 | |||
| N-cadherin | n | E-cadherin | r值 | P值 | |||
| - | + | ++ | +++ | ||||
| - | 24 | 7 | 2 | 11 | 4 | -0.478 | 0.000 |
| + | 18 | 11 | 2 | 4 | 1 | ||
| ++ | 44 | 36 | 6 | 2 | 0 | ||
| +++ | 6 | 4 | 2 | 0 | 0 | ||
| n | 58 | 12 | 17 | 5 | |||
HIF-1α的表达与淋巴结转移有关(P = 0.030); Snail的表达与TNM分期有关(P = 0.031); Slug的表达与TNM分期和淋巴结转移有关(P = 0.003; P = 0.002); N-cadherin的表达与TNM分期、淋巴结转移和肿瘤分化程度有关(P = 0.000; P = 0.001; P = 0.010); 而年龄、性别、肿瘤部位、肿瘤大小、神经侵犯、切缘与这些蛋白的表达均无关(表6).
| 参数 | n | HIF-1α | Snail | Slug | E-cadherin | N-cadherin | ||||||||||
| 低 | 高 | P值 | 低 | 高 | P值 | 低 | 高 | P值 | 阴性 | 阳性 | P值 | 低 | 高 | P值 | ||
| TNM分期 | ||||||||||||||||
| Ⅰ | 21 | 15 | 6 | 0.085 | 8 | 13 | 0.031 | 16 | 5 | 0.003 | 12 | 9 | 0.718 | 17 | 4 | 0.000 |
| Ⅱa | 37 | 21 | 16 | 23 | 14 | 19 | 18 | 25 | 12 | 17 | 20 | |||||
| Ⅱb, Ⅲ, Ⅳ | 34 | 14 | 20 | 11 | 23 | 10 | 24 | 21 | 13 | 8 | 26 | |||||
| 淋巴结转移 | ||||||||||||||||
| 阴性 | 57 | 36 | 21 | 0.030 | 30 | 27 | 0.086 | 35 | 22 | 0.002 | 36 | 21 | 0.977 | 34 | 23 | 0.001 |
| 阳性 | 35 | 14 | 21 | 12 | 23 | 10 | 25 | 22 | 13 | 8 | 27 | |||||
| 分化 | ||||||||||||||||
| G1 | 14 | 10 | 4 | 0.336 | 8 | 6 | 0.349 | 7 | 7 | 0290 | 8 | 6 | 0.857 | 9 | 5 | 0.010 |
| G2 | 60 | 30 | 30 | 28 | 32 | 32 | 28 | 39 | 21 | 29 | 31 | |||||
| G3 | 16 | 8 | 8 | 5 | 11 | 5 | 11 | 10 | 6 | 2 | 14 | |||||
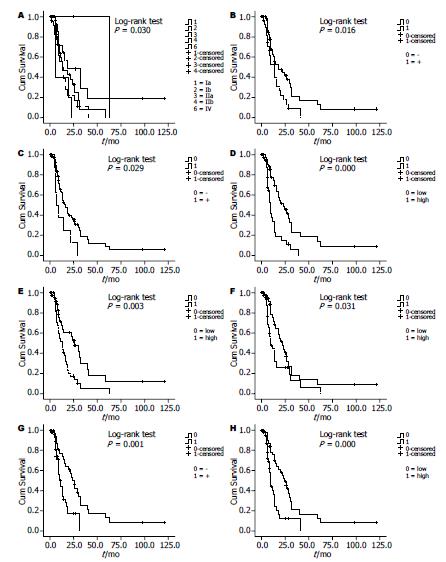
单因素生存分析结果显示, TNM分期、淋巴结转移、切缘、HIF-1α、Snail、Slug、E-cadherin、N-cadherin的表达与患者预后有关(P<0.05), 而年龄、性别、肿瘤部位、肿瘤大小、神经浸润、组织病理学分级与患者预后均无关(P>0.05, 表7, 图3).
| 参数 | 单因素P值 | 多因素 | ||
| P值 | RR | 95%CI | ||
| 年龄(≤60岁vs >60岁) | 0.796 | |||
| 性别(男vs女) | 0.217 | |||
| 部位(头部vs体尾部) | 0.194 | |||
| 大小(≤2 cm vs >2 cm) | 0.203 | |||
| TNM分期(Ⅰa/Ⅰb/Ⅱa/Ⅱb/Ⅲ/Ⅳ) | 0.030 | 0.001 | 1.545 | 1.206-1.978 |
| 淋巴结(阴性vs阳性) | 0.016 | 0.433 | ||
| 切缘(阴性vs阳性) | 0.029 | 0.733 | ||
| 神经(阴性vs阳性) | 0.902 | |||
| 分化(G1/G2/G3) | 0.167 | |||
| HIF-1α(高表达vs低表达) | 0.000 | 0.001 | 2.678 | 1.500-4.781 |
| Snail(高表达vs低表达) | 0.003 | 0.002 | 2.553 | 1.411-4.616 |
| Slug(高表达vs低表达) | 0.031 | 0.455 | ||
| E-cadherin(阳性vs阴性) | 0.001 | 0.001 | 0.327 | 0.173-0.618 |
| N-cadherin(高表达vs低表达) | 0.000 | 0.370 | ||
将单因素分析有统计学意义的8个因素引入Cox比例风险模型进行多因素分析. 根据多因素生存分析结果, TNM分期、HIF-1α、Snail和E-cadherin的表达是胰腺癌患者术后的独立预后因素(P<0.05, 表7).
肿瘤缺氧微环境与肿瘤的演进密切相关[13,14]. 影像学显示胰腺癌特有的乏血管表现[15]和肿瘤内部氧分压测定[16]都提示胰腺癌组织缺氧, 充分说明胰腺癌是一个乏氧性肿瘤. 但缺氧与胰腺癌恶性生物学特征之间的关系仍然是未解之谜.
HIF-1是在缺氧状态下发挥特异性活性的核转录因子[17], 含有α及β亚基的异源二聚体, 生理活性主要取决于α亚基, β亚基组成表达[18]. 多位学者采用免疫组织化学的方法检测了实体癌中HIF-1α的表达, 并研究其表达与肿瘤生物学行为及预后之间的关系. Cao等[19]研究发现71例结直肠癌患者手术标本HIF-1α阳性率为54.93%, 并且HIF-1α的表达与TNM分期、淋巴结和肝转移及预后有关. Chen等[20]在54例食管癌中研究发现HIF-1α阳性率为46%, 与预后密切相关. 在胰腺癌中, 我们前期研究也发现PDAC组织中亦存在HIF-1α过表达, 且HIF-1α的表达与淋巴结转移、临床病理分期及预后有关[6]. Hoffmann等[21]检测了41例PDAC患者手术标本HIF-1α阳性率为87.1%, 与预后有关. 但也有相反的研究报道. Zhu等[22]检测了60例PDAC患者手术标本和正常胰腺组织内HIF-1α的表达, 发现两者没有差异, 并且PDAC患者手术标本中HIF-1α的表达与预后无关. 本研究结果显示: 92例PDAC患者手术标本HIF-1α阳性率为69.57%, 且HIF-1α的表达与淋巴结转移有关, 即患者胰腺癌组织中的HIF-1α表达阳性细胞越多, 其发生淋巴结转移的可能性就越大. 生存分析显示HIF-1α是PDAC患者术后的独立预后因子. HIF-1α是胰腺癌细胞缺氧的一个标志物, 这提示胰腺癌的恶性生物学行为与胰腺癌缺氧微环境之间可能存在密切联系.
EMT是近年来肿瘤转移过程中的一个研究热点[23]. 目前EMT的形成机制中比较明确的是转录因子Snail、Slug通过结合到E-cadherin启动子区域的E盒结构, 进而下调E-cadherin的表达[24]. Hotz等[12]研究发现78%的人胰腺癌组织中表达Snail, 50%的癌组织阳性表达Slug. Snail在未分化癌细胞株MiaPaCa-2和Panc-1中的表达明显高于分化程度高的细胞株Capan-1、HPAF-2和AsPC-1. Slug在所有细胞株的表达强度不同. 源于两个未分化肿瘤细胞株MiaPaCa-2和Panc-1转移能力显著强于来自中等分化的HPAF-2和分化良好的Capan-1, Snail mRNA的表达和转移潜能呈正相关. Yin等[25]检测了56例胰腺癌手术标本中Snail的表达, 结果发现Snail的表达阳性率为36%, 与淋巴结和远处转移呈正相关. 他们还将Snail cDNA转染Panc-1细胞, 转染后的细胞侵袭能力明显增加. 但也有学者的研究结果与之不同. Cates等[26]的研究结果显示在正常胰腺上皮、慢性胰腺炎、PDAC标本中胞质和胞核均有Slug阳性染色. Slug的表达与癌组织病理分级、肿瘤分期和淋巴结转移无关. 本研究结果显示, 92例PDAC组织中, Snail、Slug、E-cadherin、N-cadherin的阳性表达率分别为69.57%、58.70%、36.96%、73.91%; 10例正常胰腺组织中Snail、Slug、N-cadherin均不表达, E-cadherin阳性率为90%. Snail的表达与TNM分期有关; Slug的表达与TNM分期和淋巴结转移有关; N-cadherin的表达与TNM分期、淋巴结转移和肿瘤分化程度有关. 生存分析显示Snail和E-cadherin的表达是影响患者预后的独立因素. 这在组织学层面上证实EMT的发生与胰腺癌转移有关, 参与胰腺癌的恶性进展而影响预后. 此外, 我们还证实胰腺癌中Snail的表达与E-cadherin的表达呈负相关, 提示Snail可能调控胰腺癌组织中E-cadherin的表达.
目前的研究表明: HIF-1α和EMT相关因子都在肿瘤的转移方面发挥重要的作用[5,18,27-30]. HIF-1α对EMT相关转录因子Twist、Snail、Slug的调控是缺氧诱导肿瘤EMT的重要机制, 其在肿瘤的侵袭转移方面发挥重要作用. Yang等[31]研究发现Twist启动子区域存在HRE, 受HIF-1α调控. Imai等[32]采用缺氧处理卵巢癌细胞发现, 缺氧活化HIF-1α, 促使Snail表达上调, 抑制E-cadherin的表达. Huang等[33]通过体内外实验证实HIF-1α上调Slug的表达, 且Slug与MMP4启动子区域的E盒结合, 进而上调MMP4的表达. 另外在头颈部癌手术标本中发现HIF-1α和MMP4的表达与预后负相关. 我们的研究结果表明: 胰腺癌中HIF-1α的表达与Snail、Slug表达呈正相关, 即随着HIF-1α阳性表达细胞的增多, Snail、Slug阳性表达也随之增多. 首次在PDAC手术标本中证实缺氧的肿瘤细胞可能发生EMT, 提示缺氧微环境下胰腺癌细胞可能通过EMT获得高侵袭转移能力, 在胰腺癌的恶性进展中发挥重要作用.
总之, HIF-1α和EMT相关蛋白在胰腺癌的演进及预后中发挥重要作用, 联合使用免疫组织化学检测, 可考虑作为胰腺癌临床评价生物学行为及判断预后的有用指标.
缺氧是实体瘤微环境的一个重要特征, 癌细胞为适应缺氧而发生一系列生物学特性的改变. HIF-1α和EMT相关因子在其中发挥重要作用.
孙诚谊, 教授, 贵阳医学院附属医院院长办
近年来, 缺氧微环境下EMT与肿瘤转移的相关研究已成为肿瘤研究领域的新热点. 其中钙黏素转换和转录因子的表达上调是EMT发生过程中重要的分子事件. 但HIF-1α与EMT相关因子在胰腺癌组织中的表达是否相关及其在胰腺癌演进中的作用还不明确.
Imai等采用缺氧处理卵巢癌细胞发现, 缺氧活化HIF-1α, 促使Snail表达上调, 抑制E-cadherin的表达.
本课题采用免疫组织化学法检测胰腺癌组织中HIF-1α、Snail、Slug、E-cadherin、N-cadherin蛋白的表达, 并统计分析其表达的相关性及与临床病理特征和预后的关系. 首次在胰腺导管腺癌手术标本中证实缺氧的肿瘤细胞可能发生EMT, 在胰腺癌的恶性进展中发挥重要作用.
HIF-1α和EMT相关蛋白在胰腺癌的演进及预后中发挥重要作用, 联合使用免疫组织化学检测, 可考虑他作为胰腺癌临床评价生物学行为及判断预后的有用指标.
本文学术性较好, 具有较好的实用性和创新性.
编辑:李薇 电编:何基才
| 1. | Melillo G. Targeting hypoxia cell signaling for cancer therapy. Cancer Metastasis Rev. 2007;26:341-352. [PubMed] [DOI] |
| 3. | Koh MY, Spivak-Kroizman TR, Powis G. HIF-1alpha and cancer therapy. Recent Results Cancer Res. 2010;180:15-34. [PubMed] [DOI] |
| 4. | Majmundar AJ, Wong WJ, Simon MC. Hypoxia-inducible factors and the response to hypoxic stress. Mol Cell. 2010;40:294-309. [PubMed] [DOI] |
| 5. | DeClerck K, Elble RC. The role of hypoxia and acidosis in promoting metastasis and resistance to chemotherapy. Front Biosci. 2010;15:213-225. [PubMed] [DOI] |
| 6. | Sun HC, Qiu ZJ, Liu J, Sun J, Jiang T, Huang KJ, Yao M, Huang C. Expression of hypoxia-inducible factor-1 alpha and associated proteins in pancreatic ductal adenocarcinoma and their impact on prognosis. Int J Oncol. 2007;30:1359-1367. [PubMed] |
| 7. | Acloque H, Adams MS, Fishwick K, Bronner-Fraser M, Nieto MA. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease. J Clin Invest. 2009;119:1438-1449. [PubMed] [DOI] |
| 8. | Brabletz T, Jung A, Spaderna S, Hlubek F, Kirchner T. Opinion: migrating cancer stem cells - an integrated concept of malignant tumour progression. Nat Rev Cancer. 2005;5:744-749. [PubMed] [DOI] |
| 9. | Yilmaz M, Christofori G. EMT, the cytoskeleton, and cancer cell invasion. Cancer Metastasis Rev. 2009;28:15-33. [PubMed] [DOI] |
| 10. | Gospodarowicz MK. International Union against Cancer: Pancreas. UICC-TNM classification of malignant tumours, 6th ed. New York: Wiley-Liss 2002; 132-135. |
| 11. | Lüttges J, Schemm S, Vogel I, Hedderich J, Kremer B, Klöppel G. The grade of pancreatic ductal carcinoma is an independent prognostic factor and is superior to the immunohistochemical assessment of proliferation. J Pathol. 2000;191:154-161. [PubMed] [DOI] |
| 12. | Hotz B, Arndt M, Dullat S, Bhargava S, Buhr HJ, Hotz HG. Epithelial to mesenchymal transition: expression of the regulators snail, slug, and twist in pancreatic cancer. Clin Cancer Res. 2007;13:4769-4776. [PubMed] [DOI] |
| 13. | Klein TJ, Glazer PM. The tumor microenvironment and DNA repair. Semin Radiat Oncol. 2010;20:282-287. [PubMed] [DOI] |
| 14. | Grek CL, Tew KD. Redox metabolism and malignancy. Curr Opin Pharmacol. 2010;10:362-368. [PubMed] [DOI] |
| 15. | Megibow AJ. Pancreatic adenocarcinoma: designing the examination to evaluate the clinical questions. Radiology. 1992;183:297-303. [PubMed] |
| 16. | Koong AC, Mehta VK, Le QT, Fisher GA, Terris DJ, Brown JM, Bastidas AJ, Vierra M. Pancreatic tumors show high levels of hypoxia. Int J Radiat Oncol Biol Phys. 2000;48:919-922. [PubMed] [DOI] |
| 17. | Chitneni SK, Palmer GM, Zalutsky MR, Dewhirst MW. Molecular imaging of hypoxia. J Nucl Med. 2011;52:165-168. [PubMed] [DOI] |
| 18. | Lu X, Kang Y. Hypoxia and hypoxia-inducible factors: master regulators of metastasis. Clin Cancer Res. 2010;16:5928-5935. [PubMed] [DOI] |
| 19. | Cao D, Hou M, Guan YS, Jiang M, Yang Y, Gou HF. Expression of HIF-1alpha and VEGF in colorectal cancer: association with clinical outcomes and prognostic implications. BMC Cancer. 2009;9:432. [PubMed] [DOI] |
| 20. | Chen Y, Lu Y, Lu C, Zhang L. Beclin-1 expression is a predictor of clinical outcome in patients with esophageal squamous cell carcinoma and correlated to hypoxia-inducible factor (HIF)-1alpha expression. Pathol Oncol Res. 2009;15:487-493. [PubMed] [DOI] |
| 21. | Hoffmann AC, Mori R, Vallbohmer D, Brabender J, Klein E, Drebber U, Baldus SE, Cooc J, Azuma M, Metzger R. High expression of HIF1a is a predictor of clinical outcome in patients with pancreatic ductal adenocarcinomas and correlated to PDGFA, VEGF, and bFGF. Neoplasia. 2008;10:674-679. [PubMed] |
| 22. | Zhu DM, Li DC, Zhang ZX, Zhang XY. Effect of endothelial PAS domain protein 1 and hypoxia inducible factor 1alpha on vascular endothelial growth factor expression in human pancreatic carcinoma. Chin Med J (Engl). 2008;121:2258-2264. [PubMed] |
| 24. | Peinado H, Olmeda D, Cano A. Snail, Zeb and bHLH factors in tumour progression: an alliance against the epithelial phenotype? Nat Rev Cancer. 2007;7:415-428. [PubMed] [DOI] |
| 25. | Yin T, Wang C, Liu T, Zhao G, Zha Y, Yang M. Expression of snail in pancreatic cancer promotes metastasis and chemoresistance. J Surg Res. 2007;141:196-203. [PubMed] [DOI] |
| 26. | Cates JM, Byrd RH, Fohn LE, Tatsas AD, Washington MK, Black CC. Epithelial-mesenchymal transition markers in pancreatic ductal adenocarcinoma. Pancreas. 2009;38:e1-e6. [PubMed] [DOI] |
| 27. | Ruan K, Song G, Ouyang G. Role of hypoxia in the hallmarks of human cancer. J Cell Biochem. 2009;107:1053-1062. [PubMed] [DOI] |
| 28. | Micalizzi DS, Farabaugh SM, Ford HL. Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression. J Mammary Gland Biol Neoplasia. 2010;15:117-134. [PubMed] [DOI] |
| 29. | Iwatsuki M, Mimori K, Yokobori T, Ishi H, Beppu T, Nakamori S, Baba H, Mori M. Epithelial-mesenchymal transition in cancer development and its clinical significance. Cancer Sci. 2010;101:293-299. [PubMed] [DOI] |
| 30. | Tsuji T, Ibaragi S, Hu GF. Epithelial-mesenchymal transition and cell cooperativity in metastasis. Cancer Res. 2009;69:7135-7139. [PubMed] [DOI] |
| 31. | Yang MH, Wu MZ, Chiou SH, Chen PM, Chang SY, Liu CJ, Teng SC, Wu KJ. Direct regulation of TWIST by HIF-1alpha promotes metastasis. Nat Cell Biol. 2008;10:295-305. [PubMed] [DOI] |
| 32. | Imai T, Horiuchi A, Wang C, Oka K, Ohira S, Nikaido T, Konishi I. Hypoxia attenuates the expression of E-cadherin via up-regulation of SNAIL in ovarian carcinoma cells. Am J Pathol. 2003;163:1437-1447. [PubMed] [DOI] |