修回日期: 2010-08-09
接受日期: 2010-08-17
在线出版日期: 2010-10-08
目的: 研究COX-2与C/EBP β在肝细胞肝癌(HCC)组织中的表达, 二者的相关性及其与临床病理指标的关系.
方法: 用免疫组织化学方法对59例HCC患者的手术切除标本中COX-2与C/EBP β的表达进行检测. 以18例肝血管瘤患者手术切除标本中正常组织作为正常对照.
结果: COX-2在HCC组织中呈高表达(阳性率为72.9%, P<0.05); 肝功能分级A级, TNM分期Ⅰ、Ⅱ期, 肿瘤直径<5 cm. 在未发生血管侵犯、未发生淋巴结转移以及未发生远处转移的患者中高表达(P<0.05); C/EBP β在HCC中呈高表达(阳性率为47.5%, P<0.05). 在有饮酒史、肿瘤直径<5 cm、TNM分期Ⅰ、Ⅱ期的HCC患者中高表达; HCC组织中C/EBP β的表达与COX-2呈正相关(r = 0.580, P<0.05).
结论: COX-2可能与HCC发生的早期阶段有关, C/EBP β相关的信号转导通路可能在肝癌发生早期的COX-2高表达调节中起到一定的作用.
引文著录: 梁熹, 胡雅楠, 和水祥, 邓元, 李晓峰, 张雅欣, 侯和磊, 朱占芳. COX-2与C/EBP β在人肝细胞肝癌中的表达及其临床意义. 世界华人消化杂志 2010; 18(28): 3040-3044
Revised: August 9, 2010
Accepted: August 17, 2010
Published online: October 8, 2010
AIM: To investigate the expression of cyclooxygenase-2 (COX-2) and CCAAT/enhancer binding protein β (C/EBP β) and to analyze their correlation with the clinical pathological parameters in hepatocellular carcinoma (HCC).
METHODS: The expression of COX-2 and C/EBP β in 59 HCC tissue specimens and 18 normal hepatic tissue specimens were detected by immunohistochemistry.
RESULTS: The positive rate of COX-2 expression in HCC was 72.9% (P < 0.05). COX-2 expression was correlated with Child-Pugh classification, tumor diameter, TNM stage, vein invasion, lymph node metastasis, and distant metastasis (P < 0.05). The positive rate of C/EBP β expression in HCC was 47.5% (P < 0.05). C/EBP β expression was correlated with history of alcohol use, tumor diameter and TNM stage (P < 0.05). A close correlation was noted between the expression of COX-2 and C/EBP β (r = 0.580, P < 0.05).
CONCLUSION: COX-2 is overexpressed in HCC and may be involved in early hepatocarcinogenesis. C/EBP β-related signal pathway may up-regulate the expression of COX-2 in the early stage of HCC.
- Citation: Liang X, Hu YN, He SX, Deng Y, Li XF, Zhang YX, Hou HL, Zhu ZF. Significance of COX-2 and C/EBP β expression in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(28): 3040-3044
- URL: https://www.wjgnet.com/1009-3079/full/v18/i28/3040.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i28.3040
肝细胞肝癌(hepatocellular carcinoma, HCC)是一种常见的恶性肿瘤. 目前早期HCC最为有效的治疗方法是手术治疗, 但大多数患者在诊断时已为晚期, 失去了手术机会, 而且没有有效的治疗手段. 药物靶向治疗为HCC的治疗开辟了一个新途径, 故对HCC发病途径的研究极为必要. 环氧合酶2(cyclooxygenase-2, COX-2)为催化花生四烯酸生成前列腺素(prostaglandins, PGs)的关键酶, 在多种恶性肿瘤包括HCC中都有高表达, 且在肿瘤发病中起重要的作用. 而有关COX-2在HCC发病中的作用及其与临床病理指标间是否存在联系, 尚无定论. 关于COX-2表达的调节, 有研究表明, COX-2基因的转录能够被核因子κB(nuclear factor-kappa B, NF-κB)、CCAAT增强子结合蛋白δ、β(CCAAT enhancer binding protein δ、β, C/EBP δ, C/EBP β)、cAMP反应因子结合蛋白(cAMP response element-binding protein, CREB)和活化蛋白1 (activator protein-1, AP-1)等激活. C/EBP β作为COX-2转录上游一个重要的调控因子, 在HCC中的作用及其对COX-2的转录调节影响尚不十分清楚, 有待进一步阐明. 本试验对59例HCC患者的肝切除标本进行免疫组织化学染色, 研究COX-2与C/EBP β在正常组织和HCC组织中的表达, 二者的相关性及其与临床病理指标的关系.
选择西安交通大学第一附属医院2007- 03/2010-04经临床诊断原发性HCC, 并接受外科手术治疗的患者82例. 剔除临床资料不全者9例, 术前或术中行射频消融治疗或化学治疗的肝癌患者13例, 经术后病理证实为胆管腺癌1例, 取临床资料完整, 并经病理确诊的HCC患者59例入选本研究. 其中男46例, 女13例, 年龄24-68(平均年龄49.93)岁, 45岁以上36例, 45岁及以下23例. 收集患者临床资料进行分类统计, 以手术切除的新鲜肝癌组织或保留的肝癌组织蜡块标本为对象进行免疫组织化学染色. 同时以18例肝血管瘤患者的临床资料和瘤旁正常组织作为正常对照组. COX-2兔抗人多克隆抗体(即用型)、MAXVISION两步法免疫组织化学试剂盒购自福建迈新试剂公司. C/EBP β兔抗人多克隆抗体购自Santa Cruz公司(用PBS稀释为浓度1:200).
石蜡切片以二甲苯脱蜡、无水酒精水化, 用新鲜配制的3%甲醇-双氧水, 室温10 min去除内源性过氧化物酶. 用蒸馏水和pH为7.4的PBS缓冲液清洗后, 高温高压修复: 置于pH为6.0柠檬酸缓冲液入高压锅中加热至沸腾, PBS缓冲液冲洗. 滴加一抗, 室温孵育2 h. 用PBS冲洗后, 滴加MAXVISION检测试剂, 常温下反应30 min. 再用PBS冲洗. DAB显色, 自来水冲洗, 苏木素复染或轻染; 自来水冲洗, 梯度酒精脱水, 二甲苯透明, 中性树胶封片. 显微镜下观察: 随机选择10个高倍视野, 每个视野计数100个细胞中的阳性数, 取平均数作为结果, 阳性数: 0%-4%计0分, 5%-24%计1分, 25%-49%计2分, 50%-74%计3分, 75%-100%计4分; 染色强度: 阴性计0分, 弱阳性计1分, 强阳性计2分; 总值为0分定为-, 1-2分定为+, 3-4分定为++, 5-6分定为+++. 其中-和+为低表达(阴性), ++和+++为高表达(阳性).
统计学处理 COX-2与C/EBP β表达相关性的研究采用Spearman秩相关分析; 余资料采用χ2检验或Fisher确切概率法, 应用SPSS17.0软件进行分析. 以P<0.05为有统计学差异.
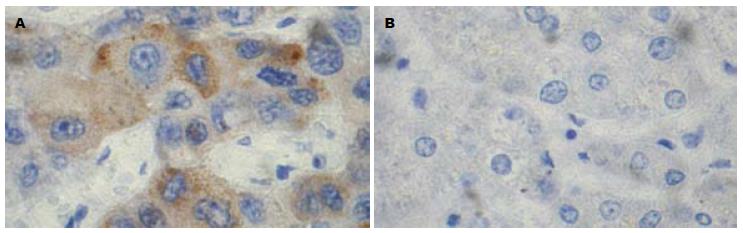
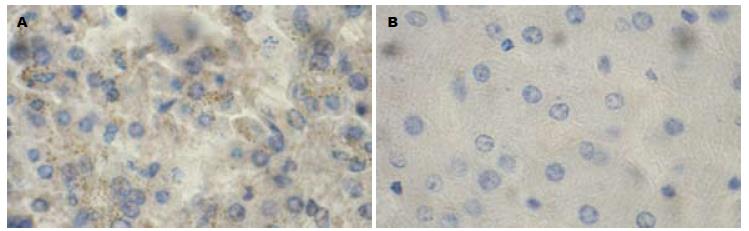
COX-2表达阳性颗粒主要定位于胞质中, 呈黄至棕黄色颗粒. COX-2在HCC组织中表达的阳性率为72.9%, 在正常组织中表达的阳性率为22.2%. Fisher确切概率法显示二者之间的差别具有统计学意义(P<0.05). COX-2在HCC组织中的表达为肝功能A级; TNM分期(AJCC第6版)Ⅰ、Ⅱ期; 肿瘤直径<5 cm; 在未发生血管侵犯、未发生淋巴结转移以及未发生远处转移的患者中表达较高(P<0.05). 而与年龄、性别、是否合并肝硬化、HBV感染等因素无关(表1, 图1).
| 临床病理指标 | n | COX-2阳性表达 | C/EBP β阳性表达 | ||||
| n(%) | χ2值 | P值 | n(%) | χ2值 | P值 | ||
| 肝癌组织 | 59 | 43(72.9) | 28(47.5) | ||||
| 正常肝组织 | 18 | 4(22.2) | 0.000 | 2(11.1) | 0.006 | ||
| 年龄(岁) | |||||||
| >45 | 36 | 26(72.2) | 18(50.0) | ||||
| ≤45 | 23 | 17(73.9) | 0.020 | 0.887 | 10(43.4) | 0.239 | 0.625 |
| 性别 | |||||||
| 男 | 46 | 33(71.7) | 20(43.5) | ||||
| 女 | 13 | 10(76.9) | 1.000 | 8(61.5) | 1.326 | 0.250 | |
| 吸烟 | |||||||
| 有 | 27 | 21(77.8) | 13(48.1) | ||||
| 无 | 32 | 22(68.8) | 0.604 | 15(46.9) | 0.010 | 0.922 | |
| 饮酒 | |||||||
| 有 | 21 | 16(76.2) | 14(66.7) | ||||
| 无 | 38 | 27(71.1) | 0.181 | 0.671 | 14(36.8) | 4.825 | 0.028 |
| 肝功能分级 | |||||||
| A级 | 54 | 42(77.8) | 27(50.0) | ||||
| B或C级 | 5 | 1(20.0) | 0.017 | 1(20.0) | 0.356 | ||
| HBsAg | |||||||
| 阳性 | 42 | 31(73.8) | 21(50.0) | ||||
| 阴性 | 17 | 12(70.6) | 0.064 | 0.801 | 7(41.2) | 0.378 | 0.509 |
| 肿瘤直径(cm) | |||||||
| ≥5 | 35 | 21(60.0) | 8(22.9) | ||||
| <5 | 24 | 22(91.6) | 0.008 | 20(83.3) | 0.000 | ||
| 组织分化 | |||||||
| Ⅰ、Ⅱ级 | 37 | 28(75.8) | 16(43.3) | ||||
| Ⅲ、Ⅳ级 | 22 | 15(68.2) | 0.392 | 0.531 | 12(54.5) | 0.707 | 0.401 |
| 侵犯肝包膜 | |||||||
| 有 | 47 | 33(70.2) | 24(51.1) | ||||
| 无 | 12 | 10(83.3) | 0.482 | 4(33.3) | 0.342 | ||
| 合并肝硬化 | |||||||
| 有 | 48 | 36(75.0) | 22(45.8) | ||||
| 无 | 11 | 7(63.6) | 0.468 | 6(54.5) | 0.272 | 0.602 | |
| TNM分期 | |||||||
| Ⅰ、Ⅱ期 | 35 | 32(91.4) | 22(62.9) | ||||
| Ⅲ、Ⅳ期 | 24 | 11(45.8) | 0.000 | 6(25.0) | 8.183 | 0.004 | |
| 静脉侵犯 | |||||||
| 有 | 8 | 2(25.0) | 2(25.0) | ||||
| 无 | 51 | 41(80.4) | 0.003 | 26(51.0) | 0.259 | ||
| 淋巴结转移 | |||||||
| 有 | 8 | 2(25.0) | 2(25.0) | ||||
| 无 | 51 | 41(80.4) | 0.003 | 26(51.0) | 0.259 | ||
| 远处转移 | |||||||
| 有 | 4 | 0(0.00) | 0(0.00) | ||||
| 无 | 55 | 43(78.2) | 0.004 | 28(50.9) | 0.114 | ||
C/EBP β表达阳性颗粒主要定位于胞核中, 部分定位于胞质, 呈黄至棕黄色颗粒. C/EBP β在HCC组织中表达的阳性率为47.5%, 在正常组织中表达的阳性率为11.1%. 采用Fisher精确概率法, 二者之间的差别有统计学意义(P<0.05). C/EBP β在有饮酒史、肿瘤直径<5 cm 、TNM分期Ⅰ、Ⅱ期的HCC患者中表达较高(P<0.05). 与年龄、性别、是否合并肝硬化、HBV感染、静脉侵犯、淋巴结转移等临床病理指标无显著相关(表1, 图2).
59例肝细胞癌中COX-2与C/EBP β表达均为阳性的28例; 均为阴性的16例; COX-2阳性, C/EBP β阴性的15例; COX-2阴性, C/EBP β阳性0例. Spearman秩相关分析结果表明: COX-2与C/EBP β表达呈正相关(r = 0.580, P<0.05).
COX-2是催化花生四烯酸产生PGs的关键酶, 在正常生理状态下, 多数组织不表达, 当受到包括生长因子、细胞因子、炎性介质、各种促癌因素等刺激因素作用时, 其表达迅速上调. COX-2的催化产物PGs参与人体多种生理或病理过程如炎症、血管扩张以及肿瘤等. 目前, 已有许多研究证据表明, COX-2在多种肿瘤如结肠癌、胃癌、食管癌、肝癌等中存在高表达, 并且与肿瘤的发生发展密切相关[1-3]. 目前有关COX-2对肝癌的治疗作用主要处于动物实验研究阶段, 在许多体外实验中, COX-2选择性抑制剂对肝细胞癌的治疗作用得以肯定[4-7]. 本试验结果表明, COX-2在HCC组织中呈高表达, 阳性率为72.9%, 与正常组织相比较, 其表达阳性率有显著性差异(P<0.05). COX-2肝功能分级为A级; TNM分期Ⅰ、Ⅱ期; 肿瘤直径<5 cm; 未发生血管侵犯、未发生淋巴结转移以及未发生远处转移的患者中表达较高(P<0.05). 推断COX-2可能在肝癌发生的早期阶段起作用. 这与之前有相关研究所得出的COX-2在肝癌的早期阶段起作用的结论有共同之处[8-12]. 其原因可能为: 如Koga等[10]认为的在这类HCC中, 肿瘤动脉少而有潜在门脉管道, 故诱导因素可能通过门脉血流使其表达增加; 而在晚期或分化差的HCC, 由于缺乏这种途径而使其表达减少. 对于这一观点, 应该有更多有关COX-2表达调节以及影响肝癌的信号通路等分子水平予以证实.
C/EBPs主要包括C/EBP-α、C/EBP-β和C/EBP-δ等6种蛋白. 近年研究表明, C/EBP β与骨、脂肪代谢、炎症反应、病毒感染等多种病理生理过程有关[13]. 而关于其与HCC的关系目前研究较少. 本试验对C/EBP β在肝癌组织和正常肝组织中表达的研究表明, C/EBP β在肝癌组织中的阳性率为47.5%, 与其在正常肝组织中的表达有显著的统计学差别(P<0.05). C/EBP β在有饮酒史、肿瘤直径<5 cm、TNM分期Ⅰ、Ⅱ期的HCC患者中表达较高(P<0.05). 提示C/EBP β的高表达与HCC的发生及酒精摄入有关, 但仍需大量相关实验予以证实.
最近有关人类COX-2基因启动子的研究表明, COX-2基因的转录能够被NF-κB、C/EBP δ、C/EBP β、CREB和AP-1等转录因子激活. 有关C/EBP β在COX-2转录调节中的作用, 近年有报道称在关节软骨及巨噬细胞中, C/EBP β与COX-2基因的转录有关[14]. Isoda等[15]的实验表明, 过量表达的C/EBP-β基因促进了由CCl4导致的小鼠的肝细胞的再生, 并且检测出了COX-2的过表达. Casado等[16]的研究发现COX-2在部分肝切除术后残余肝的再生过程中表达升高, 其升高的过程也伴随着C/EBP β的表达的升高. 而在HCC中二者的关系仍待研究. C/EBP β与COX-2表达相关性的试验结果表明, 二者均在HCC中呈高表达, 均在肿瘤直径<5 cm的HCC组织, TNM分期Ⅰ、Ⅱ期的HCC患者中表达较高, Spearman秩相关分析表明, C/EBP β与COX-2在HCC中的表达呈正相关(r = 0.580, P<0.05), 推测在肝癌发生的早期C/EBP β可能对COX-2的有正向调节作用. 而有关C/EBP β对COX-2基因的转录调节作用以及具体机制有待进一步地研究阐明.
研究表明, COX-2在包括HCC在内的多种肿瘤中高表达, 有关COX-2表达调节的研究也陆续展开, C/EBP β作为COX-2的转录上游一个重要调控因子, 在HCC中的作用及其对COX-2的转录调节的影响尚不十分清楚, 有待进一步阐明.
高润平, 教授, 吉林大学第一医院肝病科
近年的研究表明, COX-2通过抑制肿瘤细胞凋亡、促进肿瘤细胞生长、促进肿瘤新生血管生长等途径对肿瘤的发生发展起作用. 然而, 对于COX-2在肝癌中的作用尚存在争议, 其表达的调节机制也有待研究.
本试验采用免疫组织化学方法对对59例HCC患者的手术切除标本中COX-2与C/EBP β的表达进行检测, 结果表明COX-2可能与HCC发生的早期阶段有关, C/EBP β相关的信号转导通路可能在肝癌发生早期的COX-2高表达调节中起到一定的作用.
COX-2抑制剂在临床及实验室阶段对肿瘤的抑制作用得到肯定; 对于COX-2及其抑制剂研究的不断深入, 将会为临床应用COX-2抑制剂治疗HCC开辟新的途径.
环氧合酶-2(COX-2): 是催化花生四烯酸合成前列腺素(PGs)的关键限速酶. 在机体内主要有COX-1、COX-2、COX-3 3种存在形式. COX-2参与机体多种生理过程, 如排卵、受精卵着床、溃疡愈合、炎症修复等. 当受到炎性介质、生长因子、细胞因子或细胞有丝分裂物刺激时, COX-2的表达上调. 目前许多研究表明, COX-2与包括肝癌在内的多种肿瘤的发生发展有关.
本文具有一定的创新性, 研究内容对HCC发生学机制具有一定意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Chi-Man Tang T, Tung-Ping Poon R, Fan ST. The significance of cyclooxygenase-2 expression in human hepatocellular carcinoma. Biomed Pharmacother. 2005;59 Suppl 2:S311-S316. [PubMed] [DOI] |
| 3. | 王 宝峰, 程 延安, 王 西京, 刘 振国, 马 红兵, 白 明华, 党 双锁, 贾 晓黎. 柴胡皂甙D对实验性大鼠肝癌血管形成的抑制作用. 世界华人消化杂志. 2008;16:1273-1280. [DOI] |
| 4. | Kern MA, Schöneweiss MM, Sahi D, Bahlo M, Haugg AM, Kasper HU, Dienes HP, Käferstein H, Breuhahn K, Schirmacher P. Cyclooxygenase-2 inhibitors suppress the growth of human hepatocellular carcinoma implants in nude mice. Carcinogenesis. 2004;25:1193-1199. [PubMed] [DOI] |
| 5. | Liu W, Nakamura H, Tsujimura T, Cheng J, Yamamoto T, Iwamoto Y, Imanishi H, Shimomura S, Yamamoto T, Hirasawa T. Chemoprevention of spontaneous development of hepatocellular carcinomas in fatty liver Shionogi mice by a cyclooxygenase-2 inhibitor. Cancer Sci. 2006;97:768-773. [PubMed] [DOI] |
| 6. | Kern MA, Haugg AM, Eiteneuer E, Konze E, Drebber U, Dienes HP, Breuhahn K, Schirmacher P, Kasper HU. Ex vivo analysis of antineoplastic agents in precision-cut tissue slices of human origin: effects of cyclooxygenase-2 inhibition in hepatocellular carcinoma. Liver Int. 2006;26:604-612. [PubMed] [DOI] |
| 7. | Yamanaka Y, Shiraki K, Inoue T, Miyashita K, Fuke H, Yamaguchi Y, Yamamoto N, Ito K, Sugimoto K, Nakano T. COX-2 inhibitors sensitize human hepatocellular carcinoma cells to TRAIL-induced apoptosis. Int J Mol Med. 2006;18:41-47. [PubMed] |
| 8. | Bae SH, Jung ES, Park YM, Kim BS, Kim BK, Kim DG, Ryu WS. Expression of cyclooxygenase-2 (COX-2) in hepatocellular carcinoma and growth inhibition of hepatoma cell lines by a COX-2 inhibitor, NS-398. Clin Cancer Res. 2001;7:1410-1418. [PubMed] |
| 9. | Kondo M, Yamamoto H, Nagano H, Okami J, Ito Y, Shimizu J, Eguchi H, Miyamoto A, Dono K, Umeshita K. Increased expression of COX-2 in nontumor liver tissue is associated with shorter disease-free survival in patients with hepatocellular carcinoma. Clin Cancer Res. 1999;5:4005-4012. [PubMed] |
| 10. | Koga H, Sakisaka S, Ohishi M, Kawaguchi T, Taniguchi E, Sasatomi K, Harada M, Kusaba T, Tanaka M, Kimura R. Expression of cyclooxygenase-2 in human hepatocellular carcinoma: relevance to tumor dedifferentiation. Hepatology. 1999;29:688-696. [PubMed] [DOI] |
| 11. | Shiota G, Okubo M, Noumi T, Noguchi N, Oyama K, Takano Y, Yashima K, Kishimoto Y, Kawasaki H. Cyclooxygenase-2 expression in hepatocellular carcinoma. Hepatogastroenterology. 1999;46:407-412. [PubMed] |
| 12. | Qiu DK, Ma X, Peng YS, Chen XY. Significance of cyclooxygenase-2 expression in human primary hepatocellular carcinoma. World J Gastroenterol. 2002;8:815-817. [PubMed] |
| 14. | Thomas B, Berenbaum F, Humbert L, Bian H, Béréziat G, Crofford L, Olivier JL. Critical role of C/EBPdelta and C/EBPbeta factors in the stimulation of the cyclooxygenase-2 gene transcription by interleukin-1beta in articular chondrocytes. Eur J Biochem. 2000;267:6798-6809. [PubMed] [DOI] |
| 15. | Isoda K, Koide H, Kojima M, Arita E, Ikkaku M, Higashiyama S, Tashiro F, Yamato E, Miyazaki J, Kawase M. Stimulation of hepatocyte survival and suppression of CCl4-induced liver injury by the adenovirally introduced C/EBPbeta gene. Biochem Biophys Res Commun. 2005;329:182-187. [PubMed] [DOI] |