修回日期: 2010-08-05
接受日期: 2010-08-10
在线出版日期: 2010-09-28
目的: 探讨125I粒子对低分化大肠腺癌的抑制作用及其可能的机制.
方法: 以人低分化结肠癌HCT-116细胞的荷瘤小鼠作为动物模型, 随机将其分成对照组和实验组(每组24只), 对照组植入空白粒子, 实验组植入剂量为14.8 MBq的125I粒子, 分别在植入后第7天、14天、21天、28天处死裸鼠. 计算生长曲线, 用免疫组织化学法检测增殖细胞核抗原; 以原位末端标记法检测125I粒子诱导肿瘤细胞凋亡的程度; 通过透射电镜对比观察肿瘤组织的形态学变化.
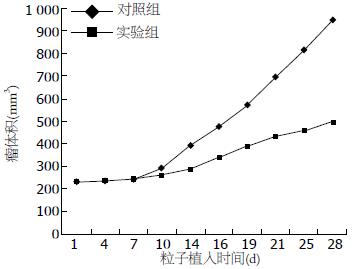
结果: 植入125I粒子第7、14、21、28天后, 实验组荷瘤小鼠肿瘤体积均明显小于对照组(第28天: 497.3 mm3±7.8 mm3vs 947.2 mm3±40.4 mm3, P<0.01). 同时, 实验组荷瘤小鼠肿瘤质量也均明显小于对照组(第28天: 1.131 g±0.079 g vs 2.139 g±0.094 g, P<0.01). 实验组的抑瘤率高于对照组(第28天: 47.12% vs 25.77%). 从第21天开始PCNA的表达逐渐降低, 在第28天时明显低于对照组, 其表达呈弱阳性(+). 植入125I粒子14 d后, 开始出现凋亡小体, 且数量逐渐增多, 以第28天时达到最大.
结论: 125I粒子对低分化大肠腺癌的治疗有效, 他能抑制肿瘤细胞的增殖生长, 诱导肿瘤凋亡.
引文著录: 陈亿, 罗开元, 李晓刚, 李滢旭, 张万福, 章治平, 褚焱. 组织间植入125I粒子对大肠腺癌细胞HCT-116诱导凋亡及增殖抑制的影响. 世界华人消化杂志 2010; 18(27): 2858-2862
Revised: August 5, 2010
Accepted: August 10, 2010
Published online: September 28, 2010
AIM: To investigate the effect of interstitial implantation of iodine-125 on the growth of adenocarcinoma of the large intestine and to explore potential mechanisms involved.
METHODS: Nude mice bearing HCT-116-xenografted tumors were randomly divided into two groups (n = 24 each): control group and experimental group. The control group underwent implantation of empty seeds, while the experiment group underwent implantation of iodine-125 seeds (14.8 MBq). On days 7, 14, 21 and 28 after implantation, mice were killed to calculate tumor growth, detect the expression of proliferating cell nuclear antigen (PCNA) in tumor tissue by immunohistochemistry, determine the apoptosis of tumor cells by terminal deoxynucleotidyl transferase dUTP nick-end labeling (TUNEL) assay, and observe the ultrastructural changes of tumor cells by transmission electron microscopy (TEM).
RESULTS: On days 7, 14, 21 and 28 after implantation, both tumor volume and weight were significantly lower in the experiment group than in the control group (tumor volume on day 28: 497.3 mm3 ± 7.8 mm3 vs 947.2 mm3 ± 40.4 mm3, P < 0.01; tumor weight on day 28: 1.131 g ± 0.079 g vs 2.139 g ± 0.094 g, P < 0.01). The reduced rate of tumor growth in the experimental group was higher than that in the control group (on day 28: 47.12% vs 25.77%). The expression of PCNA in the experiment group decreased with time and was significantly lower on day 28 than that in the control group. On day 14, apoptotic bodies began to appear and then gradually increased in number, reaching the peak on day 28.
CONCLUSION: Interstitial implantation of iodine-125 seeds induces apoptosis but inhibits cell proliferation in HCT-116-xenografted tumors in nude mice.
- Citation: Chen Y, Luo KY, Li XG, Li YX, Zhang WF, Zhang ZP, Chu Y. Interstitial implantation of iodine-125 seeds induces apoptosis but inhibits cell proliferation in HCT-116-xenografted tumors in nude mice. Shijie Huaren Xiaohua Zazhi 2010; 18(27): 2858-2862
- URL: https://www.wjgnet.com/1009-3079/full/v18/i27/2858.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i27.2858
随着社会经济的发展以及生活方式和饮食习惯的改变, 大肠癌在我国发病率呈逐年上升趋势, 自20世纪70年代开始其年增长率达4%. 目前在美国大肠癌已成为导致患者癌性死亡的第3大疾病, 接近25%的结直肠癌患者在确立诊断时即已存在肝转移, 患者生存期明显缩短且生活质量不高[1-4]. 近年来国外已有报道125I粒子(全称是125I密封粒子)组织间植入内放疗对肿瘤的治疗取得了良好疗效, 使之成为治疗大肠癌的重要手段[5,6]. 本研究设计了以125I粒子为干预因素, 研究肿瘤细胞的增殖和凋亡以及起效的时间周期, 证实了125I粒子在不同的时间周期对大肠腺癌均有疗效.
48只BLAB/c-nu/nu裸鼠, ♂, 购于中国医学科学院肿瘤研究所, 4-6周龄时接种癌细胞株, 体质量为17-18 g. 瘤体位于腋下或肩胛区, 瘤体长径为8-10 mm, 在昆明医学院动物实验室无特定病原体(specific pathogen-free, SPF)条件下饲养. 125I粒子: 125I粒子24粒(放射性活度: 14.8 MBq), 空载粒子(0 MBq)24粒(购于上海欣科医药公司). 125I是一种人工合成的同位素, 由124Xe吸收一个中子并以电子俘获方式变为125I, 释放能量为27-31 KEV的X线和35 KEV的γ射线. 125I粒子目前已被广泛应用于临床各种实体恶性肿瘤的放射治疗[7].
1.2.1 分组及造模: 按单纯随机化原则分为实验组和对照组, 其中每组为24只, 每组又按处死时间的不同, 即植入粒子后第1周(7 d)、第2周(14 d)、第3周(21 d)、第4周(28 d)分为A、B、C、D 4组. 对照组中的每只裸小鼠于肿瘤中心处植入一粒空白粒子(0 MBq), 实验组中的每只裸小鼠用18号植入针经皮于瘤体中心处(平行于瘤体长轴)植入一125I粒子(14.8 MBq). 植入后每隔3 d用游标卡尺测量肿瘤长径(a)及宽径(b), 计算肿瘤体积(V = ab2/2), 并绘制出各组裸小鼠移植瘤生长曲线图.
1.2.2 TUNEL法检测原位凋亡: 镜下观察凋亡细胞计算染色阳性细胞所占百分比, 即为细胞凋亡指数(apoptosis index, AI)[8].
1.2.3 增殖细胞核抗原的阳性判断: 增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)位于细胞核膜上, 免疫组织化学染色, PCNA阳性表现为细胞核呈棕黄色. 结果判定参照Shimizu判定标准: 无明显阳性细胞为(-), 阳性细胞百分率1%-25%为(+), 26%-50%为(++), 51%-75%为(+++), 76%-100%为(++++), 并分析比较PCNA标记指数(labelling index, LI)[9].
统计学处理 实验数据均用SPSS11.5医学统计软件进行统计分析. 数据以mean±SD表示, 采用LSD法和χ2检验, P<0.05有统计学意义, P<0.01有显著性差异.
随着时间的推移, 对照组多数裸小鼠进食、活动明显减少, 而实验组裸小鼠多活跃且进食多, 背部肿瘤局部皮肤未见溃烂现象. 对照组首先进行数据正态性检验, 统计量Z = 1.162, P = 0.134. 采用随机区组方差分析进行检验, 差异显著(F = 35.289, P = 0.000), 粒子植入后对照组瘤体积大于实验组(表1). 肉眼观察也可见对照组的瘤体积明显大于实验组. 从各组的生长曲线看, 对照组的肿瘤生长曲线高抬, 粒子植入后第10天可见生长曲线明显上抬, 表明肿瘤生长速度显著增快. 而实验组生长曲线一直低平, 无明显曲线抬高现象, 从大体标本上也可看出对照组的瘤体生长迅速, 部分瘤体出现坏死, 破溃, 两组肿瘤大小差异显著(P<0.01, 图1).
肿瘤抑制率对照组瘤质量大于实验组瘤质量, 两组瘤质量差异有统计学意义(P<0.05). 实验组荷瘤裸鼠在粒子植入21 d时, 瘤质量增长的速度开始减慢, 差异有统计学意义(P<0.05). 28 d时的瘤质量, 与植入21 d相比, 瘤体生长速度继续减慢, 差异有统计学意义(P<0.05). 与对照组相比, 21 d以前, 瘤体生长速度不明显, 21 d以后, 瘤体生长速度明显增高. 4个组的抑瘤率分别为: 11.76%, 14.88%, 25.77%, 47.12%(表2).
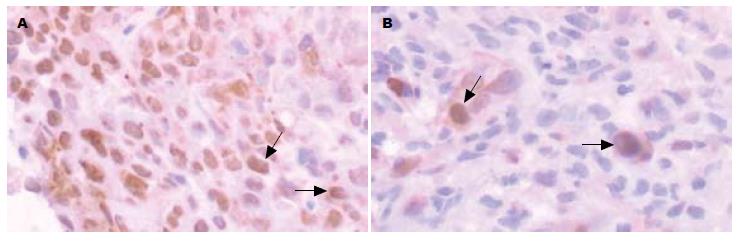
PCNA指数是计数资料, 经卡方检验分析, 实验组第1组与对照组第1组之间比较, 差异无统计学意义(P>0.05). 其余实验组与相应对照组之间对比, 差异有统计学意义(P<0.05). 提示实验组第1组PCNA表达降低不明显, 与对照组第1组一致, PCNA表达均呈强阳性(++++). 从21 d开始, 实验组PCNA表达逐渐减弱, 到28 d PCNA表达呈弱阳性(+)(图2).
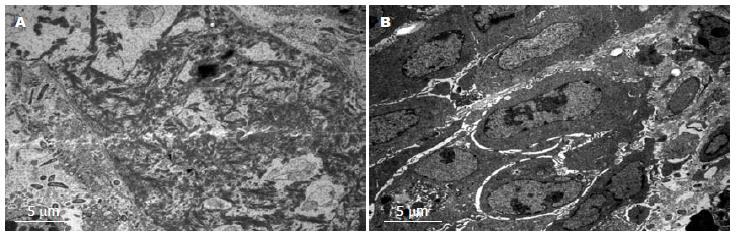
经125I粒子作用后, 第1、2、3、4实验组均可见不同时期的细胞凋亡, 胞质固缩染色体边集, 以早中期凋亡为主. 照射14 d以后, 开始出现凋亡小体, 且数量也增多, 以第28天时最多. 部分切片肿瘤细胞中可见空泡, 微丝的形成, 内部的细胞器也增多, 与对照组相比, 凋亡细胞明显. 对照组早期癌细胞排列整齐, 核大, 有异形, 细胞内少见凋亡. 中晚期细胞以坏死为主, 并伴有较多炎性细胞, 几乎不能找到凋亡小体, 与实验组相比, 凋亡小体较少见(图3).
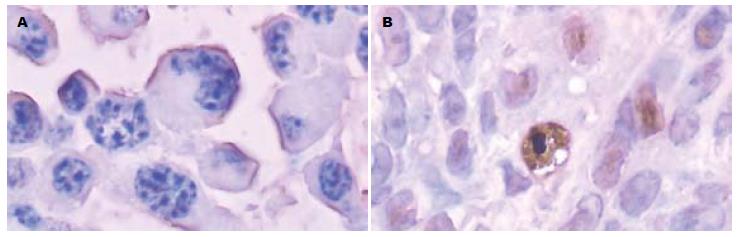
实验组中随着粒子照射时间的延长, 凋亡小体逐渐增多, 照射第14天后凋亡小体增多明显, 第28天时最多, 镜下可见细胞核呈棕黄色, 细胞核明显偏位, 呈月牙形, 可见空泡现象. 高倍镜视野(400×HP)下可见较多凋亡小体, 与对照组相比, 凋亡情况明显(图4).
大肠癌的发生不仅与抑癌基因失活有关, 还与细胞增生凋亡被抑制有关[10-12]. 细胞凋亡是1972年由Kerr等[13]首先提出的, 他又被称为细胞的程序性死亡, 是指在一定的条件下, 细胞接受到某种信号的刺激后, 自行控制发生的自杀死亡过程. 在本实验中, 对照组标本同本课题组前期实验中空白剂量组标本相似[14], 其中难以找到凋亡细胞. 实验组电镜标本中可见较多, 较清楚的凋亡细胞, 说明在治疗组瘤体内凋亡确实发生. TUNEL法检测组织切片上原位凋亡, 对照组中棕黄色染色的细胞数量少. 实验组中棕黄色染色细胞明显增多, 且染色加深, 说明在瘤体内自发凋亡细胞数量少, 当一定活度的125I粒子植入组织间一段时间后, 凋亡细胞数量明显增加, 而且组织间植入的125I粒子时间不同, 凋亡情况也不一样. 从21 d开始, 随着放射时间的延长, 凋亡小体的数量明显增多, 并伴有肿瘤细胞分化的改变, 微丝的形成, 高尔基体和粗面内置网数量有少许增多. 125I粒子诱导了肿瘤细胞的凋亡. 凋亡率随着放射时间的延长而增高, 从而可以推测肿瘤细胞对放射的敏感度[15].
PCNA首先由Miyachi等[16]提出, 发现其存在于细胞核, 也是核内合成的, 而不是从细胞质进入细胞核. 他是与细胞周期相关的36×103核蛋白, 又称周期素, 是反映肿瘤增殖细胞活性的一个重要指标, 也是DNA聚合酶的辅助因子, 参与DNA的合成[17-19]. 本实验从PCNA的免疫组织化学照片可以看到, PCNA在对照组中表达均较高, 染色细胞呈深黄色且阳性细胞密集. 在实验组中其表达均降低, 染色细胞呈棕黄色且阳性细胞稀疏. 从21 d开始, 随着放射时间的延长, PCNA的表达明显减弱. 结果提示我们, 125I粒子组织间植入后明显降低了肿瘤组织中PCNA的表达, 从21 d开始效果较为明显. 这表明125I粒子组织间植入治疗可以抑制瘤组织中肿瘤细胞的增殖活性, 并且随着时间的延长, 肿瘤细胞的增殖活性受到的抑制增强[20].
本实验研究结果显示: 125I粒子对大肠腺癌治疗有效, 从21 d开始效果较明显, 并持续作用; 125I粒子组织间植入治疗降低了肿瘤细胞PCNA的表达, 促使凋亡增加, 并伴有微丝的形成, 高尔基体和粗面内置网数量有少许增多. 125I粒子组织间植入内放疗的并发症较少见, 国内外对放射性粒子植入治疗的并发症均有报道. 常见的并发症有: (1)穿刺误入血管引起栓塞, 穿破空腔脏器肠管; (2)皮肤溃疡少数患者(0.5%)可造成放射性肠炎、肝脓肿[21]. 合适的粒子剂量、及时有效地预测粒子迁移[22], 可以明显减少并发症.
组织间植入放射性粒子近距离治疗恶性肿瘤, 是指通过将放射性粒子直接永久植入肿瘤组织内或是插植于手术切除的肿瘤床、残存癌及淋巴转移的途径, 利用其释放低能量光子产生的γ、X射线持续照射肿瘤细胞并将其杀伤的一种新的技术方法. 他可以减轻手术创伤、缩短手术时间、减少术后并发症; 粒子植入与手术和化疗配合, 有望提高肿瘤治疗的彻底性, 解决在恶性肿瘤治疗中起关键作用的肿瘤局部复发与再生长问题; 能够有效延长患者生存期和提高患者的生存质量.
王志刚, 副主任医师, 上海市第六人民医院普外科
肿瘤术后或放疗后局部复发和再生成为临床外科医生面临的相当棘手的问题, 癌复发的外科治疗也已成为当今研究的重要课题.
本研究设计了以125I粒子为干预因素, 研究肿瘤细胞的增殖和凋亡以及起效的时间周期, 证实了125I粒子在不同的时间周期对大肠腺癌均有疗效.
治疗结直肠癌并肝脏转移的主要方式为手术切除主要转移灶, 而后植入125I, 放射治疗潜在的残余病灶, 切除困难者以及可能发生的转移灶, 并联合新辅助化疗, 这在大肠癌的治疗中具有重要意义. 本文为提高肿瘤患者的生存率, 改善患者的生活质量, 为肿瘤的综合治疗提供一种新的有效的治疗方法.
本文选题新颖, 设计合理, 结果可信, 具有一定的科学价值.
编辑: 李军亮 电编:何基才
| 1. | Kunnumakkara AB, Diagaradjane P, Anand P, Harikumar KB, Deorukhkar A, Gelovani J, Guha S, Krishnan S, Aggarwal BB. Curcumin sensitizes human colorectal cancer to capecitabine by modulation of cyclin D1, COX-2, MMP-9, VEGF and CXCR4 expression in an orthotopic mouse model. Int J Cancer. 2009;125:2187-2197. [PubMed] [DOI] |
| 2. | Grundmann RT, Hermanek P, Merkel S, Germer CT, Grundmann RT, Hauss J, Henne-Bruns D, Herfarth K, Hermanek P, Hopt UT. [Diagnosis and treatment of colorectal liver metastases - workflow]. Zentralbl Chir. 2008;133:267-284. [PubMed] [DOI] |
| 3. | Donadon M, Torzilli G. [Surgical treatment of liver metastases from colorectal carcinoma]. Minerva Chir. 2007;62:257-267. [PubMed] |
| 4. | Donadon M, Ribero D, Morris-Stiff G, Abdalla EK, Vauthey JN. New paradigm in the management of liver-only metastases from colorectal cancer. Gastrointest Cancer Res. 2007;1:20-27. [PubMed] |
| 6. | Chino K, Silvain D, Grace A, Stubbs J, Stea B. Feasibility and safety of outpatient brachytherapy in 37 patients with brain tumors using the GliaSite Radiation Therapy System. Med Phys. 2008;35:3383-3388. [PubMed] [DOI] |
| 8. | Mitsuhashi N, Kobayashi S, Doki T, Kimura F, Shimizu H, Yoshidome H, Ohtsuka M, Kato A, Yoshitomi H, Nozawa S. Clinical significance of alpha-fetoprotein: involvement in proliferation, angiogenesis, and apoptosis of hepatocellular carcinoma. J Gastroenterol Hepatol. 2008;23:e189-e197. [PubMed] [DOI] |
| 9. | Gestin JF, Loussouarn A, Bardiès M, Gautherot E, Gruaz-Guyon A, Saï-Maurel C, Barbet J, Curtet C, Chatal JF, Faivre-Chauvet A. Two-step targeting of xenografted colon carcinoma using a bispecific antibody and 188Re-labeled bivalent hapten: biodistribution and dosimetry studies. J Nucl Med. 2001;42:146-153. [PubMed] |
| 10. | Tritz R, Hickey MJ, Lin AH, Hadwiger P, Sah DW, Neuwelt EA, Mueller BM, Kruse CA. FAPP2 gene downregulation increases tumor cell sensitivity to Fas-induced apoptosis. Biochem Biophys Res Commun. 2009;383:167-171. [PubMed] [DOI] |
| 11. | Benchabane H, Ahmed Y. The adenomatous polyposis coli tumor suppressor and Wnt signaling in the regulation of apoptosis. Adv Exp Med Biol. 2009;656:75-84. [PubMed] [DOI] |
| 12. | Imamura T, Kikuchi H, Herraiz MT, Park DY, Mizukami Y, Mino-Kenduson M, Lynch MP, Rueda BR, Benita Y, Xavier RJ. HIF-1alpha and HIF-2alpha have divergent roles in colon cancer. Int J Cancer. 2009;124:763-771. [PubMed] [DOI] |
| 13. | Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer. 1972;26:239-257. [PubMed] |
| 15. | Sahu RP, Epperly MW, Srivastava SK. Benzyl isothiocyanate sensitizes human pancreatic cancer cells to radiation therapy. Front Biosci (Elite Ed). 2009;1:568-576. [PubMed] |
| 16. | Miyachi H, Azuma A, Hioki E, Kobayashi Y, Iwasaki S, Hashimoto Y. Inducer-specific regulators of tumor necrosis factor alpha production. Chem Pharm Bull (Tokyo). 1996;44:1980-1982. [PubMed] |
| 17. | López Castel A, Tomkinson AE, Pearson CE. CTG/CAG repeat instability is modulated by the levels of human DNA ligase I and its interaction with proliferating cell nuclear antigen: a distinction between replication and slipped-DNA repair. J Biol Chem. 2009;284:26631-26645. [PubMed] [DOI] |
| 18. | Stoimenov I, Helleday T. PCNA on the crossroad of cancer. Biochem Soc Trans. 2009;37:605-613. [PubMed] [DOI] |
| 19. | Ramakrishnan G, Lo Muzio L, Elinos-Báez CM, Jagan S, Augustine TA, Kamaraj S, Anandakumar P, Devaki T. Silymarin inhibited proliferation and induced apoptosis in hepatic cancer cells. Cell Prolif. 2009;42:229-240. [PubMed] [DOI] |
| 20. | Kumar R, Singh PK, Sharma A, Prasad J, Sagar R, Singh S, Arora R, Sharma RK. Podophyllum hexandrum (Himalayan mayapple) extract provides radioprotection by modulating the expression of proteins associated with apoptosis. Biotechnol Appl Biochem. 2005;42:81-92. [PubMed] [DOI] |
| 21. | Gasent Blesa JM, Dawson LA. Options for radiotherapy in the treatment of liver metastases. Clin Transl Oncol. 2008;10:638-645. [PubMed] [DOI] |
| 22. | Zhu AX, Wallner KE, Frivold GP, Ferry D, Jutzy KR, Foster GP. Prostate brachytherapy seed migration to the right coronary artery associated with an acute myocardial infarction. Brachytherapy. 2006;5:262-265. [PubMed] [DOI] |