修回日期: 2010-04-15
接受日期: 2010-04-20
在线出版日期: 2010-05-08
目的: 探讨人食管癌细胞株EC109蛋白酶激活受体-2(PAR-2)的表达, 以及内源性PAR-2激动剂胰蛋白酶和PAR-2激动肽SLIGKV对该细胞侵袭转移的影响及其可能的分子机制.
方法: 采用RT-PCR法和免疫细胞化学染色法检测EC109细胞中PAR-2 mRNA及蛋白的表达情况; 胰蛋白酶和SLIGKV对细胞施加干预后, MTT法检测细胞增殖情况, Transwell小室法检测细胞侵袭和迁移能力的变化, RT-PCR法检测PAR-2、MMP-2/MMP-9 mRNA表达的变化, 明胶酶谱法检测MMP-2、MMP-9明胶酶活性的变化.
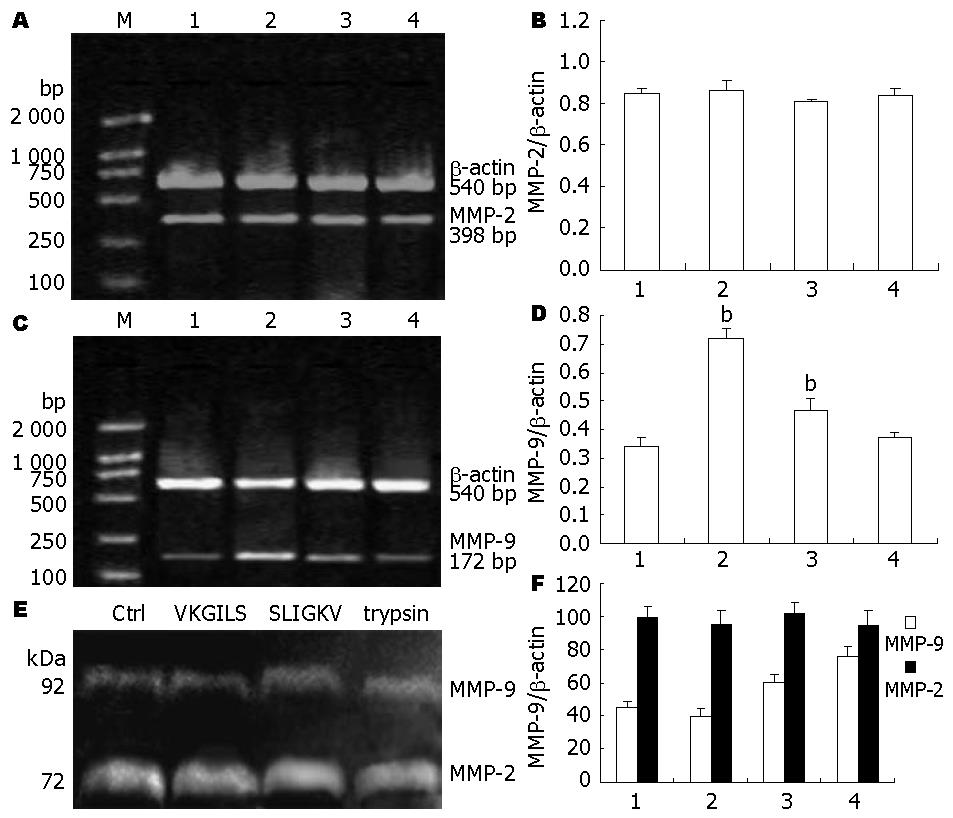
结果: 食管癌细胞EC109在胰蛋白酶和SLIGKV刺激后, PAR-2 mRNA表达较对照组显著上调(0.781±0.045、0.653±0.029 vs 0.491±0.032, 均P<0.01); 胰蛋白酶在1-10 nmol/L、SLIGKV在1-50 μmol/L时可促进细胞增殖(P<0.01或0.05), 呈剂量依赖性; Transwell小室实验中胰蛋白酶组及SLIGKV组的细胞侵袭和迁移能力显著高于对照组及反肽组(72.5±9.2、59.4±8.7 vs 31.6±6.6、36.2±9.8, 均P<0.01); 胰蛋白酶及PAR-2激动肽作用后细胞MMP-9 mRNA的表达量明显高于对照组及反激动肽组(0.719±0.034、0.466±0.042 vs 0.341±0.032、0.370±0.021, 均P<0.01), 细胞水解明胶的能力也明显高于对照组及反激动肽组(75.6±6.1、60.4±4.6 vs 44.9±4.2、39.3±5.2, 均P<0.01). 而对MMP-2的mRNA表达和水解明胶的能力无明显影响(P>0.05).
结论: 食管癌EC109细胞表达PAR-2受体, 且内源性PAR-2激动剂胰蛋白酶和PAR-2激动肽SLIGKV可能通过激活PAR-2受体上调MMP-9表达, 进而促进食管癌细胞侵袭转移.
引文著录: 周静, 谢立群, 李轩, 陈小义, 陈莉, 郑艳敏, 李飞. 蛋白酶激活受体2激动剂对食管癌EC109细胞侵袭转移的促进作用. 世界华人消化杂志 2010; 18(13): 1313-1319
Revised: April 15, 2010
Accepted: April 20, 2010
Published online: May 8, 2010
AIM: To determine the expression of protease activated receptor-2 (PAR-2) in human esophageal cell line EC109, and to evaluate the effects of PAR-2 activation on cell invasion and migration.
METHODS: The expression of PAR-2 protein and mRNA in EC109 cells was determined by immunocytochemistry and reverse transcription-polymerase chain reaction (RT-PCR), respectively. Methyl thiazol tetrazolium (MTT) assay, cell invasion and migration assay, semi-quantitative PCR and zymographic analysis were performed to examine whether endogenous PAR-2 activator trypsin and PAR-2 activating-peptide SLIGKV could alter cell proliferation, invasion, migration, and matrix metalloproteinase (MMP) production.
RESULTS: Both PAR-2 mRNA and protein were expressed in EC109 cells. PAR-2 mRNA was up-regulated in cells treated with trypsin or PAR-2-activating peptide SLIGKV (0.781 ± 0.045 and 0.653 ± 0.029 vs 0.491 ± 0.032, both P < 0.01), but not in those treated with control peptide VKGILS (P > 0.05). Trypsin and SLIGKV promoted the proliferation of EC109 cells in a dose- and time-dependent manner. No significant difference was noted in cell proliferation between untreated cells and cells treated with control peptide VKGILS. Treatment with trypsin or SLIGKV significantly increased the number of EC109 cells that passed through the Millicell inserts in the migration assay (72.5 ± 9.2 vs 31.6 ± 6.6, and 59.4 ± 8.7 vs 36.2 ± 9.8, both P < 0.01). Compared with untreated cells and cell treated with control peptide, trypsin and SLIGKV significantly increased the mRNA expression (0.719 ± 0.034 vs 0.341 ± 0.032, and 0.466 ± 0.042 vs 0.370 ± 0.021, both P < 0.01) and gelatinolytic activity (75.6 ± 6.1 vs 44.9 ± 4.2, and 60.4 ± 4.6 vs 39.3 ± 5.2, both P < 0.01) of MMP-9.
CONCLUSION: PAR-2 is expressed in EC109 cells. PAR-2 activation may be able to promote the invasion and metastasis of human esophageal carcimoma cells by stimulating MMP-9 production.
- Citation: Zhou J, Xie LQ, Li X, Chen XY, Chen L, Zheng YM, Li F. Protease-activated receptor-2 agonists promote cell invasion and metastasis in human esophageal cancer cell line EC109. Shijie Huaren Xiaohua Zazhi 2010; 18(13): 1313-1319
- URL: https://www.wjgnet.com/1009-3079/full/v18/i13/1313.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i13.1313
食管癌是消化系最常见的恶性肿瘤之一, 进展较快, 易发生淋巴结转移, 预后较差, 这与其高度的恶性生物学行为有关. 其中侵袭和转移是癌细胞最具特征性的生物学恶性特点, 与预后密切相关. 因此进一步研究食管癌细胞侵袭转移的潜在分子机制对寻找新的治疗方法具有重要意义. 蛋白酶激活受体-2(proteinase-actived receptors 2, PAR-2)是细胞膜上的一种G蛋白偶联受体, 胰蛋白酶是该受体的天然激动剂, PAR-2在多种消化系肿瘤中都有表达, 且强度高于正常组织细胞, 与肿瘤的增殖、侵袭和转移密切相关. 已有研究表明食管癌组织表达PAR-2受体[1], 然而关于PAR-2受体及其内源性激动剂胰蛋白酶是否参与食管癌侵袭转移的机制目前尚未见报道. 本研究中, 我们体外培养人食管癌细胞株EC109, 通过RT-PCR和免疫细胞化学的方法研究了EC109细胞中PAR-2受体的表达水平, 以及PAR-2受体活化对EC109细胞侵袭转移的影响, 为新型抗癌药物的开发及治疗提供了一定的实验依据及理论基础.
优质胎牛血清购自中国医学科学院天津血液学研究所; RPMI 1640培养基购自Gibco公司; 胎牛血清(FBS)购自中国医学科学院天津血液学研究所; PAR-2多克隆抗体购自Santa Cruz公司; 链霉素抗生物素蛋白-过氧化酶(SP)免疫组织化学试剂盒、DAB显色试剂盒购自福州迈新生物科技开发公司; TRIzol购自Invitrogen公司; PCR marker、RT-PCR试剂盒购自大连宝生物公司; PAR-2激动剂(SLIGKV)和反PAR-2激动肽(VLGILS)均由美联(西安)生物科技有限公司合成; Matrigel胶购自BD Biosciences公司、Transwell小室购自Millipore公司、PAR-2, MMP-2, MMP-9, 引物均合成自Invitrogen生物技术公司.
1.2.1 细胞培养及实验分组: 选用含100 mL/L FBS的RPMI 1640完全培养基, 置于37 ℃、50 mL/L CO2的孵箱(相对湿度为95%)中培养. 待细胞长满培养瓶底部70%-80%时, 用0.25%胰蛋白酶: 0.03% EDTA(1:1)消化传代, 取对数生长期细胞用于实验. MTT实验, 设对照组(以培养基代替药物)、胰蛋白酶组(浓度分别为0.1, 1, 10, 100 nmol/L)、SLIGKV组(浓度分别为5, 25, 50, 100 μmol/L)、VKGILS-NH2组(浓度分别为5, 25, 50, 100 μmol/L). RT-PCR、Western blot、细胞迁移和侵袭实验、明胶酶谱实验分组为对照组、胰蛋白酶组(10 nmol/L)、SLIGKV组(50 μmol/L)、VKGILS-NH2组(50 μmol/L). 加药前应换无血清RPMI 1640培养液培养24 h使细胞周期同步化.
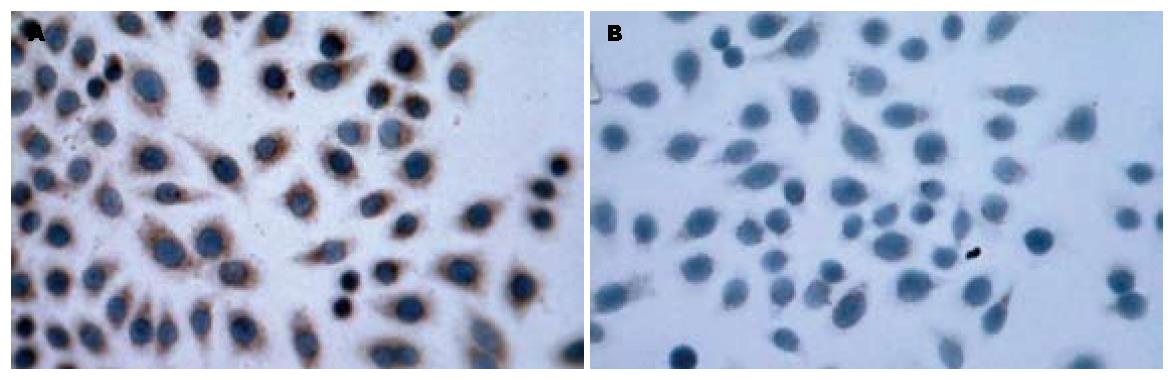
1.2.2 免疫细胞化学检测PAR-2的蛋白表达: 在预先放有盖玻片的6孔板中每孔接种1.0×105个细胞, 37 ℃培养24 h, 细胞融合达60%左右, 取出盖玻片, 用预冷的1:1混合的甲醇:丙酮固定, 3%过氧化氢去除内源性过氧化氢酶的作用, 正常山羊血清封闭液室温封闭10 min, 滴加1:100稀释的羊抗PAR-2多克隆抗体(阴性对照加PBS), 4 ℃孵育过夜, 滴加生物素标记的二抗, 37 ℃孵育10 min, 滴加辣根酶标记的链霉卵白素37 ℃孵育10 min, DAB显色, 苏木素复染, 封片并在显微镜下观察照相.
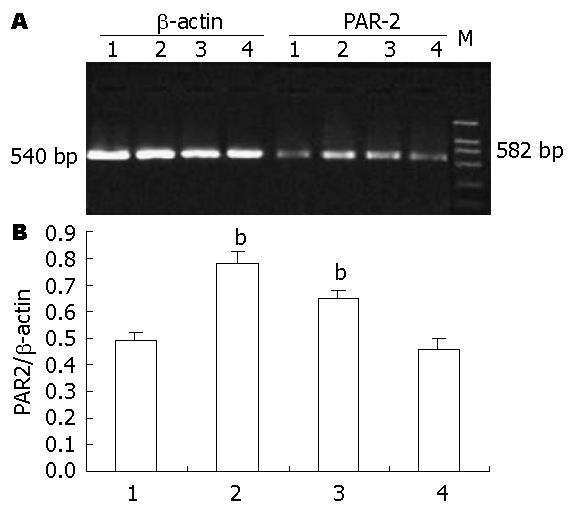
1.2.3 RT-PCR: 采用TRIzol试剂从EC109细胞中提取总RNA, 并检测RNA的含量和纯度(A260/A280为1.8-2.0). 以1%琼脂糖凝胶电泳鉴定其完整性(28S和18S RNA条带比值≥2.0). 用1 μg细胞总RNA进行逆转录, 条件如下: 30 ℃ 10 min, 42 ℃ 30 min, 99 ℃ 5 min, 5 ℃ 5 min. 应用Omiga2.0设计PAR-2的引物序列, 内参照β-actin, 引物序列如下: PAR-2(FP: 5'-AGA AGC CTT ATT GGT AAG GTT-3', RP: 5'-AAC ATC ATG ACA GGT CGT GAT-3', 扩增片段为582 bp); MMP-2(FP: 5'-CAG GCT CTT CTC CTT TCA CAA C-3', RP: 5'-AAG CCA CGG CTT GGT TTT CCT C-3', 扩增片段为398 bp); MMP-9(FP: 5'-TCC CCT ACG TCA CCT ATG ACA T-3', RP: 5'-GCC CAG CCC ACC TCC ACT CCT C-3', 扩增片段为172 bp); β-actin(FP: 5'-TGT TTG AGA CCT TCA ACA CCC-3', RP: 5'-AGC ACT GTG TTG GCG TAC AGG-3', 扩增片段为540 bp). PCR反应条件如下: PAR-2: 94 ℃, 45 s; 51 ℃, 45 s; 72 ℃, 1 min; 30个循环扩增. MMP-2: 94 ℃, 30 s; 55 ℃, 1 min; 72 ℃, 1 min; 30个循环扩增, MMP-9: 94℃, 30 s; 61 ℃, 1 min; 72 ℃, 1 min; 30个循环扩增, β-actin: 94 ℃, 1 min; 58 ℃, 30 s; 72 ℃, 1 min; 30个循环扩增. PCR产物经2%琼脂糖凝胶电泳, 结果用凝胶自动成像系统扫描, 并以β-actin校正作相对量分析, 数值以两者吸光度的比值表示.
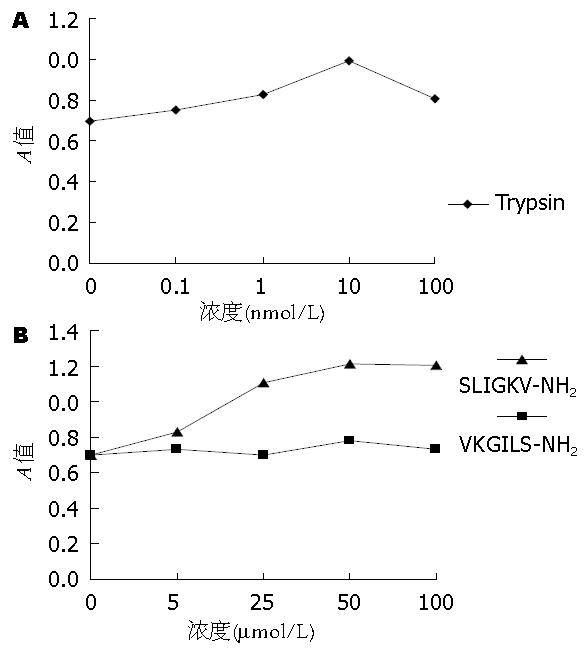
1.2.4 MTT实验: 将细胞悬液以6×104/mL的密度接种在96孔板中, 37 ℃培养24 h后更换无血清培养液继续培养24 h, 按分组加药, 每组设8个复孔, 继续培养48 h后每孔加入MTT溶液(5 g/L)20 μL, 继续培养4 h, 中止培养, 弃培养基, 每孔加入150 μL DMSO, 室温振荡混匀30 min, 使结晶物成分的溶解, 选择490 nm波长, 在酶标仪上测定各孔的A值并记录结果. 并重复进行3次实验.
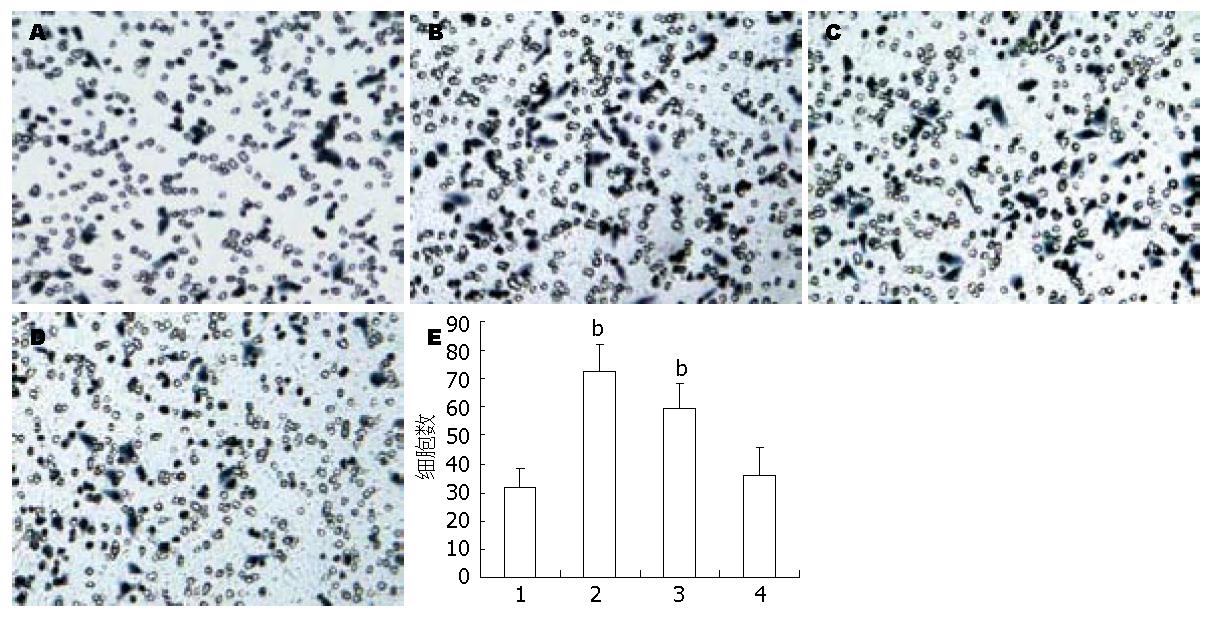
1.2.5 细胞迁移和侵袭试验: Albini等[2]设计的侵袭小室试验是体外检测肿瘤细胞侵袭能力的经典方法, 在体外较理想地模拟了侵袭和转移的过程. 其结果综合反映了肿瘤细胞的运动迁移能力和对细胞外基质的降解能力. 本试验对原试验进行了改良. 细胞迁移试验, 对数生长期EC109细胞无血清RPMI 1640培养液饥饿24 h, 0.04% EDTA消化液消化, 无血清RPMI 1640培养基悬浮成单细胞悬液, 调整细胞浓度至2.5×105/mL, 台盼蓝染色检测细胞活力95%以上. 每个millicell侵袭小室上室中加入细胞悬液0.2 mL, 同时按实验分组加药, 每加药组设3个复孔, 在侵袭小室的下室加入含10%小牛血清的细胞培养液RPMI 1640, 每孔600 μL, 培养箱中培养24 h, 取下微孔膜, 用棉球擦尽未过膜细胞后, 甲醇固定和苏木精染色. 显微镜下观察穿过膜的细胞数, 计数中间及四周5个高倍(400倍)镜下视野细胞数, 计算平均数. 细胞侵袭试验, 提前在4 ℃融解Matrigel基质胶, 每个聚碳酸酯微孔膜表面铺以40 μL稀释的Matrigel胶(matrigel与无血清培养基之比为1:4), 放入培养箱中4 h凝固备用, 接种细胞浓度调整至1.0×105/mL, 其余操作同迁徙试验.
1.2.6 明胶酶谱测定MMP-2、MMP-9酶的活性变化: 用蛋白提取液[50 mmol/L Tris (pH8.0), 1% NP-40, 0.1%十二醇硫酸钠, 0.02%叠氮钠, 150 mmol/L氯化钠和0.5%苯甲基璜酰氟]提取细胞总蛋白, 并通过BCA蛋白定量试剂盒说明测定并调整样本蛋白含量, 非还原性的10% PAGE凝胶(含1.0 g/L明胶)电泳. 室温下在洗脱液(2.5% Triton X-100, 50 mmol/L Tris-HCl, 5 mmol/L CaCl2, 1 μmol/L ZnCl2, pH7.0)中振洗3次, 每次15 min, 然后在37℃明胶酶缓冲液(50 mmol/L Tris-HCl, pH7.4; 200 mmol/L NaCl; 5 mmol/L CaCl2)中孵育过夜. 室温下在含1.0 g/L考马斯亮蓝的固定液中(乙酸:甲醇:水的浓度比为1:4:5)固定、染色各30 min; 再用不含考马斯亮蓝的固定液脱色至出现清晰透亮条带. 蛋白酶的活性部位为透亮条带. 结果用凝胶自动成像系统读取条带面积, 宽度和灰度值, 并以底部蛋白深染色条带作相对量分析, 数值以两者比值表示.
统计学处理 用SPSS11.0软件处理. 样本均数的比较采用方差分析和t检验. P<0.05为差异有显著性意义.
EC109细胞与抗PAR-2多克隆抗体有很强的结合反应, PAR-2蛋白表现为棕黄色, 着色主要在胞膜和胞质中, 而阴性对照组细胞胞膜、胞质不着色. 说明EC109细胞在蛋白水平表达PAR-2(图1).
结果显示EC109细胞在基因水平有PAR-2 mRNA的表达. 10 nmol/L胰蛋白酶、50 μmol/L SLIGKV处理细胞后, PAR-2 mRNA表达量分别为0.781±0.045、0.653±0.029(以β-actin为参照的相对灰度)与对照组(0.491±0.032)相比显著增高(P<0.05). 而50 μmol/L VKGILS组PAR-2 mRNA表达量为0.463±0.036, 与对照组相比差异无统计学意义(P>0.05, 图2). 说明SLIGKV和胰蛋白酶可上调EC109细胞PAR-2 mRNA的表达, 而VLGILS无此作用.
结果显示SLIGKV在1-50 μmol/L、胰蛋白酶在1-10 nmol/L时均能促进食管癌细胞EC109的增殖, 呈浓度依赖性(P<0.05). 而SLIGKV和胰蛋白酶的加药浓度分别达到100 μmol/L和100 nmol/L时, 食管癌细胞增殖能力分别较SLIGKV在50 μmol/L、胰蛋白酶在10 nmol/L时有所下降(P<0.05). 而1-100 μmol/L VLGILS对细胞增殖能力的影响不明显, 与对照组相比无显著意义(P>0.05, 图3). 说明适当浓度的SLIGKV和胰蛋白酶可促进食管癌细胞EC109的增殖.
肿瘤的转移包括肿瘤侵袭生长和细胞脱落进入循环流动, 与脉管内皮或组织基质黏附, 通过组织和间隙变形移动, 降解破坏细胞间质和定植生长等主要过程. 我们发现10 nmol/L胰蛋白酶和50 μmol/L SLIGKV作用24 h后, EC109细胞侵袭迁移破坏能力比对照组明显增强(图4A). 图4B显示侵袭迁移的定量数据, 在细胞侵袭迁移试验中, 胰蛋白酶组和SLIGKV组作用24 h后, EC109细胞发挥破坏Matrigel基质胶作用, 进入微孔膜内的细胞数也高于对照组与VLGILS组(72.5±9.2、59.4±8.7 vs 31.6±6.6、36.2±9.8, P<0.01).
10 nmol/L胰蛋白酶和50 μmol/L SLIGKV作用后可明显上调EC109细胞MMP-9的基因表达和酶的活性, 而对MMP-2的基因表达和酶的活性无上调作用(图5A、C、E). 图5B、D、F分别显示MMP-2、MMP-9 mRNA表达和酶活性的定量数据: RT-PCR结果显示10 nmol/L胰蛋白酶、50 μmol/L SLIGKV处理细胞后, MMP-9的mRNA表达量(以β-actin为参照的相对灰度)明显高于对照组与VLGILS组(0.719±0.034、0.466±0.042 vs 0.34±0.032、0.370±0.021), 且差异有统计学意义(P<0.01, 图5D), 而MMP-2的mRNA表达量与其他两组相比, 差别无统计学意义(P>0.05)(图5B). 明胶酶谱结果显示10 nmol/L胰蛋白酶组和50 μmol/L SLIGKV组MMP-9酶的活性明显高于对照组与VLGILS组(75.6±6.1、60.4±4.6 vs 44.9±4.2、39.3±5.2), 且差异有统计学意义(P<0.01), 而MMP-2酶的活性没有显著变化(图5F).
PAR-2是一种细胞膜表面受体, 属于与G蛋白相耦联的蛋白酶激活受体超家族成员[3], 广泛分布于各个组织和系统中, 胰蛋白酶、类胰蛋白酶、凝血因子和其他未知蛋白水解酶均为该受体的天然激动剂, 人工合成的小分子多肽SLIGKV通过模仿PAR-2受体的配体区域也可激活该受体[4-6]. PAR-2在胃、胰腺、结肠等多种消化系肿瘤中都有表达, 且强度高于正常组织细胞, 与肿瘤的增殖、侵袭和转移密切相关[7-9]. 已有研究表明, PAR-2在食管癌组织中表达, 但表达强度与正常食管相比无显著差异[1], 这与PAR-2在其他消化系肿瘤中表达上调的研究不一致, 尚需进一步研究.
胰蛋白酶属于基质丝氨酸蛋白酶(matrix serine proteases, MSPs)家族成员之一, 表达于胃、结肠等多种消化系肿瘤细胞中, 与肿瘤的增殖和侵袭转移密切相关. 胰蛋白酶是PAR-2受体的天然激动剂. 胃肠道消化液中的胰蛋白酶常随生理/病理情况下的胃食管反流作用于正常食管或食管肿瘤部位, 可引起食管黏膜急慢性损伤和炎症[10,11], 然而关于其是否参与了食管肿瘤发生与发展过程的研究, 目前尚未见相关报道.
本研究中我们通过RT-PCR和免疫细胞化学的方法证明食管癌细胞EC109在基因和蛋白水平表达PAR-2受体, 这和前人的研究相一致[1]; 实验中我们用胰蛋白酶和人工合成的PAR-2激动肽SLIGKV作用于EC109细胞发现胰蛋白酶和SLIGKV可上调PAR-2 mRNA的表达, 并促进该细胞增殖. 而反PAR-2激动肽VKGILS相对分子质量和氨基酸组成与SLIGKV完全相同, 只是氨基酸顺序不同, 不能模仿PAR-2的配体区域活化PAR-2受体, 在相同实验条件下不能上调PAR-2 mRNA的表达. 这一结果与胰蛋白酶和PAR-2激动剂在一些其他肿瘤细胞中的作用类似[7,9], 提示胰蛋白酶和PAR-2激动肽SLIGKV可活化PAR-2受体并上调其表达, 并可能发挥一些生物学效应. 胰蛋白酶和PAR-2激动肽上调PAR-2 mRNA表达的原因可能是由于PAR-2激活后出现脱敏和水解, 导致机体反馈性上调受体PAR-2 mRNA的表达.
侵袭和转移是恶性肿瘤最重要的特征之一, 也是肿瘤治疗失败的主要原因. 因此, 判断肿瘤的侵袭和转移能力尤为重要. 肿瘤细胞侵袭能力的增加有利于破坏肿瘤细胞外基质 (extracellular matrix, ECM), 促进肿瘤的转移, 有助于促进新生淋巴管和血管的形成, 为肿瘤的远处转移创造有利条件; 肿瘤细胞迁移能力的增强有利于肿瘤细胞更快穿过组织和内皮间隙, 与内皮基质结合, 为转移肿瘤团块的最终形成创造有利条件. 本研究中我们通过Tanswell小室法发现, PAR-2激活肽和胰蛋白酶可提高食管癌EC109细胞侵袭和迁移的能力, 表明PAR-2受体的活化与食管癌细胞侵袭转移密切相关, 并可能是食管癌侵袭转移过程中的重要环节. 且结果显示胰蛋白酶组比SLIGKV组肿瘤细胞的侵袭迁移能力更强, 提示胰蛋白酶还可能通过其他途径促进肿瘤侵袭转移. 胰蛋白酶促进侵袭转移的途径还有: (1)可直接降解肿瘤细胞的胞外蛋白, 攻击基底膜的Ⅰ型胶原; (2)可激活其他蛋白水解级联反应, 包括激活丝氨酸蛋白酶和基质金属蛋白酶(matrix metalloproteinases MMPs), 后者被证明是肿瘤侵袭转移最重要的酶类之一[12].
MMPs是一类具有Zn2+依赖性的内源性蛋白水解酶, 是人体内降解ECM的主要酶类, 与肿瘤侵袭和转移密切相关. MMPs参与肿瘤侵袭转移的机制主要有: (1)破坏肿瘤侵袭的组织学屏障; (2)促进新生血管的形成; (3)调节肿瘤细胞与基质的黏附; (4)激活具有潜在活性的蛋白质. 近年来的研究结果提示, MMPs是胰蛋白酶和PAR-2介导肿瘤侵袭转移的主要通路. 首先, 胰蛋白酶可通过激活MMPs, 促进多种肿瘤细胞的侵袭转移; 其次, PAR-2的活化可引起结肠癌细胞分泌MMPs, 促进转录生长因子-α(transforming growth factor-α, TGF-α)释放, 介导表皮生长因子受体(epithelial growth factor receptor, EGFR)的激活和磷酸化, 活化细胞外信号调节激酶ERK1/2, 促进结肠癌细胞增殖和侵袭转移[9,12-14]. 大量研究证实, MMP-2和MMP-9是降解型胶原最主要的酶, 其在肿瘤的新生血管形成、肿瘤细胞的浸润和转移灶的形成过程中均起重要作用[15], 是多种癌症的表型特征和重要预后标志. 胰腺癌细胞中, 胰蛋白酶可上调MMP-2表达, 促进TGF-β的释放, 进而促进VEGF分泌[16]; 而舌鳞状上皮癌细胞中TAT-2可通过上调MMP-9表达促进肿瘤侵袭[17]; 除此之外, 鼻咽癌中的PAR-2可通过上调MMP-9表达, 介导肿瘤血管生成和淋巴转移. 而本研究中我们通过RT-PCR和明胶酶谱法发现, 胰蛋白酶和PAR-2激动肽SLIGKV可上调食管癌EC109细胞MMP-9的mRNA表达, 增强MMP-9水解明胶的能力, 而对MMP-2的基因表达和酶的活性无影响. 这和上述研究的结果基本一致. 提示, 食管癌中胰蛋白酶及PAR-2激动肽可能通过激活PAR-2受体促进MMP-9的合成和分泌, 促进ECM降解或激活相关的信号传导通路最终参与食管癌细胞侵袭转移过程.
总之, PAR-2仍然是目前肿瘤研究中的一个热点, PAR-2的动态表达与肿瘤侵袭转移的关系及相关信号转导途径等都值得深入研究. PAR-2/MMPs途径在食管癌增殖及侵袭转移过程中发挥重要作用. 该途径可能成为防治食管癌的重要靶点.
蛋白酶激活受体-2(PAR-2)是一种细胞膜表面受体, 属于与G蛋白相耦联的蛋白酶激活受体超家族成员, 广泛分布于各个系统和组织中. 大量研究表明, PAR-2在多种消化系肿瘤及其微环境中都有表达, 与肿瘤的增殖、侵袭和转移密切相关.
杨建民, 教授, 浙江省人民医院消化内科.
食管癌侵袭转移是影响患者预后的主要因素. PAR-2在食管癌组织中表达, 且表达部位主要分布于食管腔内, 可被十二指肠胃食管反流液中的胰蛋白酶激活发挥生物学效应. 因此, 研究PAR-2在食管癌细胞增殖、侵袭转移中的作用对阐明食管癌发生、发展机制作用重大.
本课题组前期研究表明, PAR-2可促进肝癌细胞HepG2增殖, 其促增殖作用与ERK/AP-1途径有关; 并能促进该细胞的侵袭转移, 其具体机制与促进细胞黏附有关.
本课题采用人食管癌细胞株EC109为靶细胞, 观察该细胞中PAR-2的表达情况; 研究内源性PAR-2激动剂胰蛋白酶和人工PAR-2激动肽SLIGKV对该细胞增殖、侵袭转移的影响; 以及胰蛋白酶及PAR-2激动肽作用前后MMP-2、MMP-9表达的改变, 探讨PAR-2受体介导的食管癌细胞增殖及侵袭转移的可能分子机制.
本课题观察到PAR-2激活后对食管癌细胞增殖、侵袭转移产生强烈的刺激作用. 这些研究工作为阐明食管癌发生、发展机制提供新的理论依据.
本研究选题较好, 设计合理, 具有一定的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Ribeiro FS, Simão TA, Amoêdo ND, Andreollo NA, Lopes LR, Acatauassu R, Rumjanek FD, Albano RM, Pinto LF, Monteiro RQ. Evidence for increased expression of tissue factor and protease-activated receptor-1 in human esophageal cancer. Oncol Rep. 2009;21:1599-1604. [PubMed] |
| 2. | Albini A, Iwamoto Y, Kleinman HK, Martin GR, Aaronson SA, Kozlowski JM, McEwan RN. A rapid in vitro assay for quantitating the invasive potential of tumor cells. Cancer Res. 1987;47:3239-3245. [PubMed] |
| 3. | Jiang R, Zatta A, Kin H, Wang N, Reeves JG, Mykytenko J, Deneve J, Zhao ZQ, Guyton RA, Vinten-Johansen J. PAR-2 activation at the time of reperfusion salvages myocardium via an ERK1/2 pathway in in vivo rat hearts. Am J Physiol Heart Circ Physiol. 2007;293:H2845-H2852. [PubMed] [DOI] |
| 4. | Al-Ani B, Hansen KK, Hollenberg MD. Proteinase-activated receptor-2: key role of amino-terminal dipeptide residues of the tethered ligand for receptor activation. Mol Pharmacol. 2004;65:149-156. [PubMed] [DOI] |
| 5. | Holzhausen M, Spolidorio LC, Vergnolle N. Proteinase-activated receptor-2 (PAR2) agonist causes periodontitis in rats. J Dent Res. 2005;84:154-159. [PubMed] [DOI] |
| 6. | Kirkland JG, Cottrell GS, Bunnett NW, Corvera CU. Agonists of protease-activated receptors 1 and 2 stimulate electrolyte secretion from mouse gallbladder. Am J Physiol Gastrointest Liver Physiol. 2007;293:G335-G346. [PubMed] [DOI] |
| 7. | Caruso R, Pallone F, Fina D, Gioia V, Peluso I, Caprioli F, Stolfi C, Perfetti A, Spagnoli LG, Palmieri G. Protease-activated receptor-2 activation in gastric cancer cells promotes epidermal growth factor receptor trans-activation and proliferation. Am J Pathol. 2006;169:268-278. [PubMed] [DOI] |
| 8. | Shimamoto R, Sawada T, Uchima Y, Inoue M, Kimura K, Yamashita Y, Yamada N, Nishihara T, Ohira M, Hirakawa K. A role for protease-activated receptor-2 in pancreatic cancer cell proliferation. Int J Oncol. 2004;24:1401-1406. [PubMed] |
| 9. | Darmoul D, Marie JC, Devaud H, Gratio V, Laburthe M. Initiation of human colon cancer cell proliferation by trypsin acting at protease-activated receptor-2. Br J Cancer. 2001;85:772-779. [PubMed] [DOI] |
| 10. | Naito Y, Uchiyama K, Kuroda M, Takagi T, Kokura S, Yoshida N, Ichikawa H, Yoshikawa T. Role of pancreatic trypsin in chronic esophagitis induced by gastroduodenal reflux in rats. J Gastroenterol. 2006;41:198-208. [PubMed] [DOI] |
| 11. | Kono K, Takahashi A, Sugai H, Umekawa T, Yano T, Kamiyasu K, Teramatsu M, Fujii H. Oral trypsin inhibitor can improve reflux esophagitis after distal gastrectomy concomitant with decreased trypsin activity. Am J Surg. 2005;190:412-417. [PubMed] [DOI] |
| 12. | Moilanen M, Sorsa T, Stenman M, Nyberg P, Lindy O, Vesterinen J, Paju A, Konttinen YT, Stenman UH, Salo T. Tumor-associated trypsinogen-2 (trypsinogen-2) activates procollagenases (MMP-1, -8, -13) and stromelysin-1 (MMP-3) and degrades type I collagen. Biochemistry. 2003;42:5414-5420. [PubMed] [DOI] |
| 13. | Zeng ZS, Shu WP, Cohen AM, Guillem JG. Matrix metalloproteinase-7 expression in colorectal cancer liver metastases: evidence for involvement of MMP-7 activation in human cancer metastases. Clin Cancer Res. 2002;8:144-148. [PubMed] |
| 14. | Darmoul D, Gratio V, Devaud H, Laburthe M. Protease-activated receptor 2 in colon cancer: trypsin-induced MAPK phosphorylation and cell proliferation are mediated by epidermal growth factor receptor transactivation. J Biol Chem. 2004;279:20927-20934. [PubMed] [DOI] |
| 15. | Tack J. Review article: role of pepsin and bile in gastro-oesophageal reflux disease. Aliment Pharmacol Ther. 2005;22 Suppl 1:48-54. [PubMed] [DOI] |
| 16. | Uchima Y, Sawada T, Hirakawa K. Action of antiproteases on pancreatic cancer cells. JOP. 2007;8:479-487. [PubMed] |
| 17. | Li Z, Bian LJ, Li Y, Liang YJ, Liang HZ. Expression of protease-activated receptor-2 (PAR-2) in patients with nasopharyngeal carcinoma: correlation with clinicopathological features and prognosis. Pathol Res Pract. 2009;205:542-550. [PubMed] [DOI] |