修回日期: 2010-03-10
接受日期: 2010-03-15
在线出版日期: 2010-04-08
目的: 研究周期素依赖性激酶5(cyclin-dependent kinase5, CDK5)在肝细胞癌(hepatocellular carcinoma, HCC)发生发展中的异常表达.
方法: 应用反转录聚合酶链式反应(RT-PCR)检测CDK5 mRNA的表达水平; 免疫组织化学技术检测CDK5蛋白在正常肝组织、肝硬化和HCC组织中的表达; 分析CDK5与临床病理学特征的关系.
结果: CDK5 mRNA在HCC中呈上调表达, 阳性表达率在正常肝组织、肝硬化和HCC组织中分别为35.3%、64.3%、89.7%; 正常肝组织与HCC组织有显著差异(P<0.05), 肝硬化组织与HCC组织也有显著差异(P<0.01). CDK5蛋白在HCC中高表达, 阳性表达率在人正常肝组织、肝硬化和HCC组织之间分别为29.4%, 64.3%, 89.7%, 三组之间差异有统计学意义(χ2 = 58.095, P<0.01). HCC组织中CDK5蛋白表达强度与肿瘤的病理学分级显著相关(χ2 = 19.330, P<0.01).
结论: CDK5在HCC中上调表达, 他的异常表达在HCC的发生发展过程中发挥重要的作用, 且与肿瘤的分化程度相关.
引文著录: 董贾中, 杨玉秀, 白杨秋, 张立达. CDK5在肝细胞癌中的异常表达. 世界华人消化杂志 2010; 18(10): 1010-1015
Revised: March 10, 2010
Accepted: March 15, 2010
Published online: April 8, 2010
AIM: To investigate the abnormal expression of cyclin-dependent kinase 5 (CDK5) in hepatocellular carcinoma (HCC).
METHODS: The expression of CDK5 mRNA and protein in normal liver tissue, liver cirrhosis and HCC was measured by reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry, respectively. The relationship between CDK5 expression and the clinicopathological characteristics of HCC was then analyzed.
RESULTS: The expression of CDK5 mRNA was up-regulated in HCC when compared with noncancerous liver tissue. The positive rates of CDK5 mRNA expression were 29.4%, 64.3% and 89.7% in normal liver tissue, liver cirrhosis and HCC, respectively. Significant differences were noted in the positive rates of CDK5 mRNA expression between normal liver tissue and HCC (P < 0.05) and between liver cirrhosis and HCC (P < 0.01). Immunohistochemistry analysis also revealed up-regulated expression of CDK5 in HCC compared with noncancerous liver tissue. The positive rates of CDK5 protein were 29.4%, 64.3% and 89.7% in normal liver tissue, liver cirrhosis and HCC, respectively. Significant differences were noted in the positive rates of CDK5 protein expression among the three groups (χ2 = 58.095, all P < 0.01). The overexpression of CDK5 is significantly correlated with the pathological grade of HCC (χ2 = 19.330, P < 0.01).
CONCLUSION: CDK5 is up-regulated in HCC compared with noncancerous liver tissue. CDK5 plays an important role in the carcinogenesis of HCC. CDK5 overexpression may be related to tumor differentiation in HCC.
- Citation: Dong JZ, Yang YX, Bai YQ, Zhang LD. Abnormal expression of cyclin-dependent kinase 5 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(10): 1010-1015
- URL: https://www.wjgnet.com/1009-3079/full/v18/i10/1010.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i10.1010
肝细胞癌(hepatocellular carcinoma, HCC)是临床上最常见的恶性肿瘤之一, 是原发性肝癌最常见的一种组织学类型. 在我国, 肝癌死亡率已占恶性肿瘤的第2位, 严重威胁着人类的生命健康. 肝癌的发生是一个复杂的多病因、多阶段、多因素参与的过程, 其中抑癌基因的突变缺失、癌基因的异常扩增与表达、多基因网络式调控异常决定最终肿瘤表型的表达[1]. 慢性乙型肝炎病毒(hepatitis B virus, HBV)感染是导致肝硬化和肝癌发生的主要原因[2], 在这一过程中涉及多基因的异常表达. 我们已应用含有19 378个已知基因的寡核苷酸芯片筛选出肝硬化及HCC差异基因表达谱[3], 发现周期素依赖性激酶5(cyclin-dependent kinase 5, CDK5)在HCC组织中是一个明显高表达的基因. CDK5是CDK家族中的一员, 以前CDK5的研究主要集中在神经系统疾病, 其调节蛋白P35主要在脑组织表达, P35/CDK5在阿尔茨海默病(alzheimer's disease, AD)相关病理改变中起重要作用[4]. 目前已经发现CDK5在前列腺癌、甲状腺髓样癌、乳腺癌等多种肿瘤组织中呈现异常表达, 通过改变细胞增殖、凋亡引起肿瘤的发生发展. 但是CDK5在HCC的发生发展过程中的作用尚不明了. 本研究应用反转录聚合酶链式反应(RT-PCR)及免疫组织化学技术, 检测CDK5在人正常肝组织、肝硬化和HCC组织中的基因和蛋白的表达, 探讨CDK5在HCC演进过程中的作用及其与临床病理特征之间的关系.
2009-01/2009-06收取正常肝组织17例, 肝硬化组织14例, HCC组织39例. 其中肝硬化和HCC组织标本HBsAg均阳性, 正常肝组织HBsAg均阴性. 疾病诊断均经病理证实. 标本取出后快速置于液氮冷冻, 后转移至-80 ℃冰箱冻存待用. 标本随机取自河南省人民医院肝脏手术切除组织, 其中正常肝组织取自肝血管瘤手术切除病变部位的周围组织, 肝硬化组织取自门静脉高压行贲门周围血管离断术要求行病理检查的肝脏组织, HCC组织取自HCC手术切除组织. 所取组织新鲜, 经过患者知情同意. TRIzol Total RNA Reagent购自美国Invitrogen公司, RT-PCR试剂盒购自美国Promega公司, 兔抗人CDK5多克隆抗体购自美国Santa Cruz公司, 货号(sc-173).
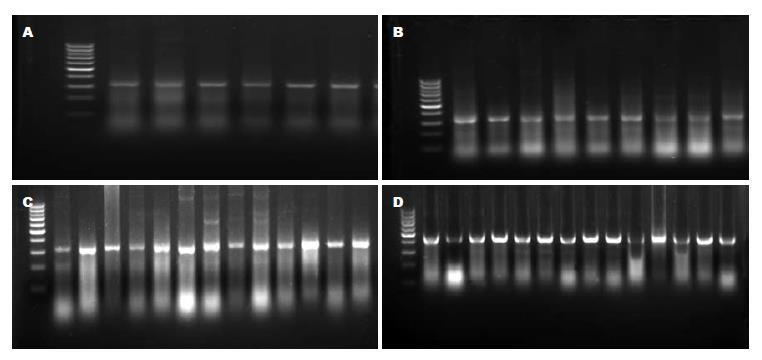
1.2.1 反转录PCR: (1)抽提总RNA: 用TRIzol试剂分别抽提正常肝组织、肝硬化和HCC组织总RNA. (2)内参基因β-actin上游引物: 5'-ACCAACTGGGACGACATGGAGAAAATC-3', 下游引物: 5'-GTAGCCGCGCTCGGTGAGGATCTTCAT-3', 扩增片段长度: 409 bp; 目的基因CDK5上游引物: 5'-GGATTCCCGTCCGCTGTT-3', 下游引物: 5'-CCTGTGGCATTGAGTTTGG-3', 扩增片段长度: 322 bp. (3)RT-PCR反应: 按照Promega公司提供的RT-PCR试剂盒的要求步骤进行反转录聚合酶链式反应, 扩增产物用2%的琼脂糖凝胶电泳鉴定. (4)扩增产物图像分析: 通过对CDK5扩增产物进行扫描和半定量分析, 结果用Syngene Gene Genius全自动凝胶成像系统(美国Syngene公司)检测图像灰度值.
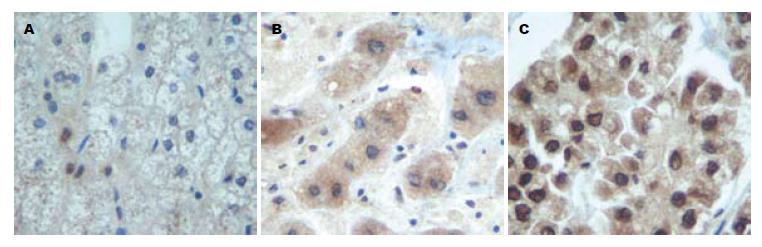
1.2.2 免疫组织化学: (1)HCC组织病理学分级: 标本经过HE染色明确诊断, 并且进行病理学分级. HCC病理学分级参照Edmondson分级. Ⅰ级: 肿瘤细胞大小一致. 核浆比类似正常肝细胞, 瘤细胞呈细索状排列; Ⅱ级: 核浆比较Ⅰ级增大, 瘤细胞呈粗索状或腺管状排列; Ⅲ级: 核浆比明显失调. 多形性明显, 索状排列紊乱, 无假腺管或胆栓形成; Ⅳ级: 核浆比严重失调细胞核大小不一. 胞质量少, 多呈实团状, 索状结构不明显. 肿瘤分化介于Ⅱ-Ⅲ级或Ⅲ-Ⅳ级之间者, 分别归入Ⅲ或Ⅳ级. 在39例HCC中, Ⅰ级7例, Ⅱ级8例, Ⅲ级10例, Ⅳ级14例. (2)免疫组织化学检测CDK5: 肝组织经梯度解冻, 100 g/L的多聚甲醛固定, 石蜡包埋, 制成4 μm厚的石蜡切片, HE染色, 组织学观察. 切片经高压热修复, 采用免疫组织化学PV法, DAB显色, 苏木素复染, 盐酸酒精分化, 无水乙醇脱水, 中性树胶封片. 以0.01 mol/L的PBS(pH7.4)代替一抗作为阴性对照, 以组织中显示棕黄色颗粒为CDK5表达阳性. (3)免疫组织化学结果判断标准: 以阳性细胞数≥10%作为阳性判断标准, 根据阳性细胞百分率分为阴性(-): 阳性细胞不可见或阳性细胞不足5%; 弱阳性(+): 阳性细胞散在或为组织细胞的1/3以下; 中度阳性(++): 阳性细胞呈局灶分布, 占全组织细胞1/3-2/3; 强阳性(+++): 阳性细胞呈弥漫分布,占全组织细胞2/3以上.
统计学处理 应用SPSS10.0进行Shapiro-Wilk检验、成组设计资料的t检验、χ2检验、Fisher's精确检验和Kruskal-Wallis非参数检验的统计学处理, 以α = 0.05为检验水准.
正常肝组织、肝硬化组织、HCC组织总RNA提取结果良好. 总RNA的吸光度A260/A280值均为1.8-2.0, 电泳结果证实RNA未降解. CDK5 RT-PCR扩增产物电泳图谱显示在相当于322 bp处有DNA片段区带, 内参基因扩增产物显示在409 bp处有DNA片段区带(图1). 17例正常肝组织中CDK5 mRNA阳性表达6例(35.3%), 14例肝硬化组织CDK5 mRNA阳性表达9例(64.3%), 39例HCC组织中CDK5 mRNA阳性表达35例(89.7%). 运用Fisher's检验得出: 正常肝组织与肝硬化组织中CDK5 mRNA表达差异无统计学意义(P>0.05), 正常肝组织与肝癌组织(P<0.01)以及肝硬化组织与肝癌组织(P = 0.044)CDK5 mRNA表达差异均有统计学意义. 以目的基因CDK5和内参基因β-actin的灰度比值作为统计学对象行mRNA半定量分析, 三组的Shapiro-Wilk检验P值分别为: 0.761、0.732、0.332, 提示各组样本符合正态分布, 运用成组设计资料t检验两两比较分析得出: 正常肝组织与肝硬化组织、正常肝组织与HCC组织以及肝硬化组织与HCC组织差异均有统计学意义(表1).
2.2.1 CDK5的表达: CDK5阳性表达物呈棕黄色颗粒, 弥散分布于正常肝细胞、肝硬化细胞胞质, 在HCC细胞中细胞质和细胞核均弥漫分布, 细胞膜未见着色. 不同病例的阳性着色颗粒的大小、分布密度及着色深浅亦有不同(图2). 正常组、肝硬化组及HCC组CDK5蛋白阳性率分别为29.4%, 64.3%, 89.7%. 应用Fisher's检验得出: 正常肝组织与肝硬化组织中CDK5蛋白表达差异无统计学意义(P>0.05), 正常肝组织与肝癌组织(P<0.01)以及肝硬化组织与肝癌组织(P = 0.044)CDK5蛋白表达差异均有统计学意义. 对三种标本的CDK5表达强度, 应用非参数检验Kruskal-Wallis统计学方法分析数据得出: 三种组织中CDK5表达强度有明显差异(χ2 = 58.095, P<0.01, 表2).
| 分组 | n | 阳性 | CDK5表达强度 | |||
| - | + | ++ | +++ | |||
| 正常肝组织 | 17 | 5 | 12 | 3 | 1 | 1 |
| 肝硬化组织 | 14 | 9 | 5 | 2 | 4 | 3 |
| HCC组织 | 39 | 35 | 4 | 5 | 10 | 20 |
2.2.2 CDK5表达强度与HCC临床病理特征的关系: CDK5在中、低分化组中的阳性表达率明显高于高分化组, 低分化组与高分化组差异有统计学意义; 在病理学分级较高的HCC组织表达较强, EdmondsonⅣ级的阳性表达率明显高于EdmondsonⅠ级, 且差别显著. 运用Kruskal-Wallis统计方法检验显示不同分化程度以及不同病理分级的HCC组织CDK5表达强度差别有显著性, HCC组织CDK5表达越强, 分化程度就越低(χ2 = 13.938, P = 0.001<0.01), 病理分级程度也越高(χ2 = 19.330, P<0.01, 表3).
| 分组 | n | 阳性n (%) | Fisher's exact (P值) | CDK5表达强度 | |||
| - | + | ++ | +++ | ||||
| HCC组织 | 39 | 35(89.7) | 4 | 5 | 10 | 20 | |
| 分化程度 | |||||||
| 高 | 9 | 6(66.7) | 3 | 4 | 1 | 1 | |
| 中 | 14 | 13(92.9) | 0.147 | 1 | 1 | 4 | 8 |
| 低 | 16 | 16(100.0) | 0.037 | 0 | 0 | 5 | 11 |
| Edmondson分级 | |||||||
| Ⅰ | 7 | 3(42.9) | 4 | 2 | 1 | 0 | |
| Ⅱ | 8 | 8(100.0) | 0.077 | 0 | 2 | 3 | 3 |
| Ⅲ | 10 | 10(100.0) | 0.051 | 0 | 1 | 3 | 6 |
| Ⅳ | 14 | 14(100.0) | 0.026 | 0 | 0 | 3 | 11 |
有资料显示, 每年全球新患肝癌人数为62.6万人, 因肝癌死亡者高达59.8万人[5], 而新发肝癌病例中50%发生于中国[6], 我国的肝癌诊治形势十分严峻. 虽然目前肝癌的发病机制研究取得了一定的进展, 但是肝癌形成的分子生物学机制的多样性决定了仅限于目前的研究是远远不够的, 对肝癌形成的分子生物学机制仍需要进一步研究, 以便能为诊断和治疗提供分子生物学依据.
CDK是细胞周期调控网络的核心蛋白, 其表达活性的改变直接影响到细胞周期的长短, 决定着细胞的进程, 与机体细胞的生长、分化、运动、凋亡以及肿瘤的发生发展、转移关系密切[7-9]. CDK5是CDK家族中的一员. 研究表明, CDK5有60%的序列和CDK2同源, 同时CDK5也包含了全部的保守的蛋白激酶区域, 并且含有CDK家族成员共有的PSTAIRE结构域[10], 但他既非细胞周期素依赖, 也不调节细胞周期, 他通过与P35或P39相互作用在有丝分裂后神经元复杂迁移、突触传递和神经细胞死亡等活动中起重要作用[11,12]. 已经证明CDK5/P35可以与多种蛋白发生相互作用, 如β-catenin、CDK5抑制因子、GFAP、dbpa DNA结合蛋白、Pctaire1、α-actinin和Ca2+-钙调蛋白依赖的蛋白激酶等[13]. 研究发现, CDK5蛋白不仅存在神经系统中, 在前列腺癌细胞中也呈现高表达, 还参与了前列腺癌细胞的转移. 在前列腺癌AT6.3细胞系中, 通过转染CDK5的反义RNA可以明显抑制癌细胞的迁移和转移[14]. 在浸润性乳腺癌细胞MDA-MB231中CDK5、P35和P25均表达, 且证明CDK5蛋白可以调控MDA-MB231细胞增殖[15]. Sharma等已经证明血管生成抑制因子可以通过选择性抑制CDK5的表达诱导细胞凋亡[16]. Goodyear对浸润性乳腺癌细胞MDA-MB231应用选择性CDK5抑制剂-roscovitine, 免疫荧光显微技术观察到用药后24 h细胞开始出现凋亡改变, 而且细胞形态学的改变随着用药时间的增加变得更加明显[15]. 由此推测, CDK5主要通过引起细胞增殖和凋亡异常引起肿瘤的发生发展的, 而不在细胞周期调节中发挥作用.
我们应用RT-PCR对CDK5 mRNA进行定性和半定量分析发现正常肝组织与HCC组织以及肝硬化组织与HCC组织差异均有统计学意义, HCC组织较正常组织mRNA表达明显升高(P<0.01); 应用免疫组织化学对CDK5进行蛋白测定发现正常肝组织与肝硬化组织中CDK5蛋白表达无明显差异, HCC组织较正常肝组织、肝硬化组织与明显升高(P<0.05), 并且其表达与HCC的分化程度、病理学分级有明显相关性(P<0.01), CDK5在中、低分化组中的阳性表达率明显高于高分化组, 且低分化组与高分化组差别显著; 病理分级较高的HCC组织表达较强, EdmondsonⅣ级的阳性表达率明显高于EdmondsonⅠ级. RT-PCR和免疫组织化学二者相互印证, 并与基因芯片结果一致. 说明CDK5的高表达与HCC的发生发展有着密切的联系.
本研究发现CDK5蛋白在正常肝组织和肝硬化组织中主要分布于细胞质, 细胞核中很少见, 而HCC组织中细胞质和细胞核均弥漫分布. CDK5抑制剂可以使CDK5/P35和磷酸化STAT3在甲状腺髓样癌细胞核中分布减少, 从而延缓肿瘤的发生发展[17]; 已经证实现HCC中P-STAT3的阳性率明显高于癌周肝组织, 认为STAT3的激活可能是HCC发生的早期事件[18,19]. Gong等发现转录因子MEF-2是CDK5的细胞核内直接靶点, CDK5可磷酸化MEF-2转录激活结构域的特异丝氨酸, 从而抑制MEF-2的活性[20]. 我们在研究过程中发现CDK5蛋白在HCC细胞中的异常分布, 提示是否由于CDK5基因发生突变导致CDK5蛋白结构异常, 从而使CDK5蛋白产生跨膜运动, 在细胞核内堆积. CDK5抑制剂是否也可以减少HCC细胞核内CDK5/P35和磷酸化STAT3, 延缓HCC的发生发展, 以及CDK5是否也可以作用于HCC细胞内的转录因子MEF-2, 使转录发生异常, 有待于进一步研究.
有资料表明, 细胞内信息传递中的某些障碍与肿瘤发生有关, 这些控制细胞增殖、凋亡的信息传递通路中某一环节的异常都可以引起细胞生长失控、凋亡受阻, 最终导致肿瘤形成. 在胶质母细胞瘤中, CDK5可以使PIKE-A的Ser-279磷酸化, 从而使下游的Akt活化[21]. 研究表明Akt/mTOR是HCC形成过程中的关键的信号转导途径. mTOR信号通路在细胞生长中处于核心地位, mTOR信号传导通路活化可以抑制多种刺激诱发的细胞凋亡, 促进细胞周期进展, 从而促进细胞的生存和增殖, 同时参与血管形成, 在肿瘤的形成中扮演重要角色, 并参与肿瘤的侵袭和转移[22-26]. Akt活化可以激活mTOR, 活化的mTOR可以磷酸化激活P70S6激酶, 后者又使40S核糖体蛋白S6磷酸化, S6磷酸化使40S亚单位参与活跃的多核糖体翻译, 从而增加包括编码核糖体蛋白、延长因子、胰岛素生长因子Ⅱ在内的含有5末端寡聚嘧啶的mRNAs的翻译[27]. HCC细胞中CDK5是否也可以通过PIKE-A-Akt途径活化Akt, 进而激活mTOR信号传导通路, 引起肿瘤的发生发展, 有待于进一步研究. CDK5的高表达也很可能通过改变细胞内信号转导途径, 致使细胞凋亡受阻, 异常增殖, 导致HCC的形成.
CDK5的高表达在HCC的发生发展过程中起着重要的作用, 进一步研究CDK5的作用机制, 有望为临床诊断、潜在的分子靶向治疗及预后判断提供分子生物学依据.
已经发现CDK5在前列腺癌、甲状腺髓样癌、乳腺癌等多种肿瘤组织中呈现异常表达, 通过改变细胞增殖、凋亡引起肿瘤的发生发展. 目前, 有关CDK5在HCC中的生物学作用和临床价值尚不甚明了, 研究其异常表达机制及与临床病理特征之间的关系, 有望为肝癌的早期诊断和靶向治疗提供分子生物学依据.
孙殿兴, 主任医师, 白求恩国际和平医院肝病科; 宣世英, 教授, 山东省青岛市市立医院肝病内科
GCDK5/P35可以与多种蛋白发生相互作用, 如β-catenin,、CDK5抑制因子、GFAP、dbpa DNA结合蛋白、Pctaire1、α-actinin和Ca2+-钙调蛋白依赖的蛋白激酶等, 而近年研究热点主要集中于肝癌细胞中CDK5是否也可以通过PIKE-A-Akt途径活化Akt, 致使细胞凋亡受阻, 异常增殖, 导致肝癌的形成.
Sharma等已经证明血管生成抑制因子可以通过选择性抑制CDK5的表达诱导细胞凋亡. Goodyear等对浸润性乳腺癌细胞MDA-MB231应用选择性CDK5抑制剂-roscovitine, 免疫荧光显微技术观察到用药后24 h细胞开始出现凋亡改变, 而且细胞形态学的改变随着用药时间的增加变得更加明显.
本研究从DNA、mRNA及蛋白水平上, 对正常肝组织、肝硬化组织、HCC组织中CDK5进行了全面系统的分析, 证明CDK5在肝癌的发展进程中呈上调表达趋势, 并与HCC的分化程度密切相关.
CDK5在肝癌的发生发展中起到相当重要的作用, 可以作为HCC早期诊断的一个候选基因. 研究CDK5上调表达的分子机制, 有望为肝癌的靶向分子治疗提供分子生物学依据.
本研究创新性好, 设计合理, 思路清晰, 数据可靠, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Lemmer ER, Friedman SL, Llovet JM. Molecular diagnosis of chronic liver disease and hepatocellular carcinoma: the potential of gene expression profiling. Semin Liver Dis. 2006;26:373-384. [PubMed] [DOI] |
| 2. | Kao JH, Chen DS. Changing disease burden of hepatocellular carcinoma in the Far East and Southeast Asia. Liver Int. 2005;25:696-703. [PubMed] [DOI] |
| 4. | Tsai LH, Lee MS, Cruz J. Cdk5, a therapeutic target for Alzheimer's disease? Biochim Biophys Acta. 2004;1697:137-142. [PubMed] |
| 5. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 6. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] [DOI] |
| 7. | Liu L, Schwartz B, Tsubota Y, Raines E, Kiyokawa H, Yonekawa K, Harlan JM, Schnapp LM. Cyclin-dependent kinase inhibitors block leukocyte adhesion and migration. J Immunol. 2008;180:1808-1817. [PubMed] |
| 8. | Shapiro GI. Cyclin-dependent kinase pathways as targets for cancer treatment. J Clin Oncol. 2006;24:1770-1783. [PubMed] [DOI] |
| 9. | Cai D, Latham VM Jr, Zhang X, Shapiro GI. Combined depletion of cell cycle and transcriptional cyclin-dependent kinase activities induces apoptosis in cancer cells. Cancer Res. 2006;66:9270-9280. [PubMed] [DOI] |
| 10. | Tarricone C, Dhavan R, Peng J, Areces LB, Tsai LH, Musacchio A. Structure and regulation of the CDK5-p25(nck5a) complex. Mol Cell. 2001;8:657-669. [PubMed] [DOI] |
| 11. | Grant P, Sharma P, Pant HC. Cyclin-dependent protein kinase 5 (Cdk5) and the regulation of neurofilament metabolism. Eur J Biochem. 2001;268:1534-1546. [PubMed] [DOI] |
| 12. | Smith DS, Tsai LH. Cdk5 behind the wheel: a role in trafficking and transport? Trends Cell Biol. 2002;12:28-36. [PubMed] [DOI] |
| 13. | Honma N, Asada A, Takeshita S, Enomoto M, Yamakawa E, Tsutsumi K, Saito T, Satoh T, Itoh H, Kaziro Y. Apoptosis-associated tyrosine kinase is a Cdk5 activator p35 binding protein. Biochem Biophys Res Commun. 2003;310:398-404. [PubMed] [DOI] |
| 14. | Strock CJ, Park JI, Nakakura EK, Bova GS, Isaacs JT, Ball DW, Nelkin BD. Cyclin-dependent kinase 5 activity controls cell motility and metastatic potential of prostate cancer cells. Cancer Res. 2006;66:7509-7515. [PubMed] [DOI] |
| 15. | Goodyear S, Sharma MC. Roscovitine regulates invasive breast cancer cell (MDA-MB231) proliferation and survival through cell cycle regulatory protein cdk5. Exp Mol Pathol. 2007;82:25-32. [PubMed] [DOI] |
| 16. | Sharma MR, Tuszynski GP, Sharma MC. Angiostatin-induced inhibition of endothelial cell proliferation/apoptosis is associated with the down-regulation of cell cycle regulatory protein cdk5. J Cell Biochem. 2004;91:398-409. [PubMed] [DOI] |
| 17. | Lin H, Chen MC, Chiu CY, Song YM, Lin SY. Cdk5 regulates STAT3 activation and cell proliferation in medullary thyroid carcinoma cells. J Biol Chem. 2007;282:2776-2784. [PubMed] [DOI] |
| 18. | Yu XT, Zhu SN, Xu ZD, Hu XQ, Zhu TF, Chen JQ, Lu SL. Roles of EGFR-Stat3 signal pathway in carcinogenesis of experimental hepatoma in rats. J Cancer Res Clin Oncol. 2007;133:145-152. [PubMed] [DOI] |
| 19. | Feng DY, Zheng H, Tan Y, Cheng RX. Effect of phosphorylation of MAPK and Stat3 and expression of c-fos and c-jun proteins on hepatocarcinogenesis and their clinical significance. World J Gastroenterol. 2001;7:33-36. [PubMed] |
| 20. | Gong X, Tang X, Wiedmann M, Wang X, Peng J, Zheng D, Blair LA, Marshall J, Mao Z. Cdk5-mediated inhibition of the protective effects of transcription factor MEF2 in neurotoxicity-induced apoptosis. Neuron. 2003;38:33-46. [PubMed] [DOI] |
| 21. | Liu R, Tian B, Gearing M, Hunter S, Ye K, Mao Z. Cdk5-mediated regulation of the PIKE-A-Akt pathway and glioblastoma cell invasion. Proc Natl Acad Sci U S A. 2008;105:7570-7575. [PubMed] [DOI] |
| 22. | Zheng Y, Collins SL, Lutz MA, Allen AN, Kole TP, Zarek PE, Powell JD. A role for mammalian target of rapamycin in regulating T cell activation versus anergy. J Immunol. 2007;178:2163-2170. [PubMed] |
| 23. | Peponi E, Drakos E, Reyes G, Leventaki V, Rassidakis GZ, Medeiros LJ. Activation of mammalian target of rapamycin signaling promotes cell cycle progression and protects cells from apoptosis in mantle cell lymphoma. Am J Pathol. 2006;169:2171-2180. [PubMed] [DOI] |
| 24. | Pene F, Claessens YE, Muller O, Viguié F, Mayeux P, Dreyfus F, Lacombe C, Bouscary D. Role of the phosphatidylinositol 3-kinase/Akt and mTOR/P70S6-kinase pathways in the proliferation and apoptosis in multiple myeloma. Oncogene. 2002;21:6587-6597. [PubMed] [DOI] |
| 25. | Wang X, Proud CG. The mTOR pathway in the control of protein synthesis. Physiology (Bethesda). 2006;21:362-369. [PubMed] [DOI] |
| 26. | Gao N, Flynn DC, Zhang Z, Zhong XS, Walker V, Liu KJ, Shi X, Jiang BH. G1 cell cycle progression and the expression of G1 cyclins are regulated by PI3K/AKT/mTOR/p70S6K1 signaling in human ovarian cancer cells. Am J Physiol Cell Physiol. 2004;287:C281-C291. [PubMed] [DOI] |