修回日期: 2009-10-13
接受日期: 2009-10-19
在线出版日期: 2009-10-28
目的: 分析人肝细胞癌(HCC)组织中磷脂酰肌醇蛋白多糖-3(GPC-3)的表达、胞内分布及其临床病理学特征.
方法: 以自身配对法分别收集36例HCC患者经手术切除后的癌灶、癌旁和远癌组织, 以免疫组织化学法检测组织中GPC-3表达及胞内分布与临床病理学特征.
结果: HCC的癌灶组织GPC-3表达于胞质和细胞膜; 癌旁组织GPC-3阳性表达主要定位于胞质, 而远癌组织未见明显表达. 癌灶组织GPC-3表达强度明显高于癌旁和远癌组织(χ2 = 11.445, P<0.01), 表达阳性率分别为80.6%、41.7%和0.
结论: HCC组织GPC-3过表达与其的发生、发展密切相关.
引文著录: 董志珍, 姚登福, 张崇国, 钱静, 李姗姗, 卞银珠, 邱历伟. 磷脂酰肌醇蛋白多糖-3在肝癌组织中的表达及其临床病理学特征. 世界华人消化杂志 2009; 17(30): 3113-3117
Revised: October 13, 2009
Accepted: October 19, 2009
Published online: October 28, 2009
AIM: To investigate the expression of human glypican-3 (GPC-3) and analyze its correlation with clinicopathological parameters in hepatocellular carcinoma (HCC).
METHODS: Tumor specimens and matched tumor-adjacent and -distant specimens were taken from 36 HCC patients. The expression of GPC-3 in these specimens was detected by immunohistochemistry.
RESULTS: Positive GPC-3 signal was localized in both cell membrane and cytoplasm in HCC, and only in cytoplasm in tumor-adjacent tissue. No positive staining was found in tumor-distant tissue. The positive rate of GPC-3 expression was 80.6% in HCC and 41.7% in tumor-adjacent tissue. The intensity of GPC-3 expression was significantly higher in HCC than in tumor-adjacent and -distant tissues (χ2 = 11.445, P < 0.01).
CONCLUSION: GPC-3 expression may be closely associated with the development and progression of HCC and can be used as a molecular marker for HCC diagnosis.
- Citation: Dong ZZ, Yao DF, Zhang CG, Qian J, Li SS, Bian YZ, Qiu LW. Glypican-3 expression and its correlation with clinicopathological parameters in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(30): 3113-3117
- URL: https://www.wjgnet.com/1009-3079/full/v17/i30/3113.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i30.3113
肝细胞癌(hepatocellular carcinoma, HCC)发生是由病毒、化学致癌物等多病因作用以及经过启动、促进、演变等多阶段的发病过程, 因癌基因或癌相关基因激活、抗癌基因失活或胚胎期某些基因重新复活等诸多因素引起肝细胞生长失控, 出现持续增殖而致癌变[1-3]. 磷脂酰肌醇蛋白多糖-3(glypican-3, GPC-3)基因位于人染色体X26.10, 由8个外显子组成, 启动子区有多个转录因子结合位点[4-5], 转录产物长度为2130 bp, 编码580个氨基酸. GPC-3与肝细胞恶性转化关系密切, 在肝细胞发生癌变过程中GPC-3呈动态表达[6]. 本研究观察了人HCC及其自身对照组织中GPC-3的表达及其临床病理学特征, 以探讨其在HCC形成中的机制和临床价值.
收集2006-2008年南通大学附属医院HCC患者(男31例, 女5例)术后新鲜肝脏组织, 按自身配对法, 分别留取HCC切除后的癌灶组织、癌旁组织(距癌灶边缘2 cm)、远癌组织(距癌灶边缘5 cm)各36份(每份约200 mg), 除部分作组织病理学检查外, 其余组织置-85℃保存. 36份标本中HCC肿块直径≥5 cm有14例, <5 cm 22例(其中<3.0 cm, 13例), HCC患者年龄35-69(平均50.9±9.8)岁. 36例标本已经组织病理学(HE染色)证实其类型均为HCC, 其中高分化7例、中分化24例及低分化5例; 肿瘤单发30例, ≥2个6例; HBsAg阳性者31例、阴性者5例. 所有病例均有完整随访资料, 按全国HCC防治协作组制定的标准核实诊断[7].
1.2.1 肝组织总RNA提取与浓度分析: 称取HCC组织或癌周组织50 mg, 置于经0.1% DEPC水处理过的匀浆器中, 加入1 mL TRIzol, 冰浴匀浆. 吸1 mL匀浆液至离心管中, 4℃离心15 000 r/min×10 min. 取上清0.8 mL, 加入0.2 mL氯仿, 震荡2 min, 4℃离心10 000 r/min×10 min. 取上清0.3 mL, 加100%异丙醇0.3 mL, 再加50%异丙醇0.5 mL, 震荡30 s, 4℃离心15 000 r/min×5 min. 弃上清, 加1 mL 750 mL/L乙醇, 轻轻洗涤沉淀. 4℃离心15 000 r/min×5 min. 弃上清, 室温静置3 min, 将乙醇晾干. 加20 μL 0.1%氯化锂溶解沉淀, 50℃孵育5 min. 在核酸蛋白分析仪上测定吸光度值(A值)A260/A280与总RNA浓度.
1.2.2 免疫组织化学染色(链霉亲和素-生物素法, SP法): 取新鲜肝组织, 固定、浸蜡, 作成厚度4 μm的组织切片, 常规脱蜡、水化, 双氧水阻断内源性过氧化物酶, 高压加热法修复抗原, 正常动物血清封闭非特异性结合, 滴加GPC-3抗体, 4℃过夜, 磷酸盐缓冲液漂洗, 滴加生物素标记的第二抗体, 室温孵育10 min, PBS漂洗, 滴加链霉素抗生物素蛋白-过氧化酶, 室温孵育10 min, PBS冲洗, 滴加新鲜配制的四盐酸二氨基联苯胺溶液, 室温显色, 蒸馏水洗涤, 苏木素复染, 无水乙醇脱水透明、封片. Olympus BX50光学显微镜观察、摄像, 以0.01 mol/L PBS液(pH7.5)分别替代一抗、二抗作阴性对照.
1.2.3 阳性结果判断标准: HCC组织中显示棕黄色颗粒为GPC-3表达阳性. 肝组织中GPC-3表达强度: +, 阳性细胞数为10%-25%; ++, 阳性细胞数为26%-75%; +++, 阳性细胞数>75%.
统计学处理 样本率之间的比较采用确切概率(Fisher's exact)法, 用SPSS13.0统计软件处理和分析数据, 以P<0.05表示差异有显著性.
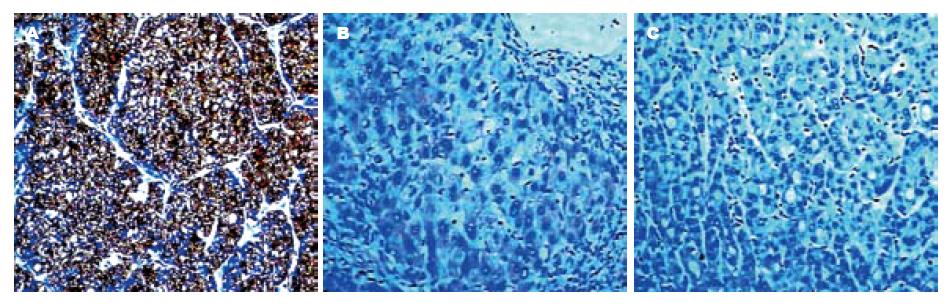
HCC及部分癌周组织中GPC-3阳性表达呈棕黄色. 癌组织中GPC-3呈巢状分布, 深染, 细胞胞质和细胞膜均呈阳性; 而对应癌周组织GPC-3阳性表达, 主要定位于胞质, 而细胞膜无明显阳性着色; 远癌组织未见表达, HCCGPC-3表达强度明显高于癌周组织(图1).
HCC组总RNA为12.4±7.3 mg/g肝, 癌周组为53.8±52.0 mg/g肝, 后者大约是前者的4倍(t = 3.05, P<0.01). 癌灶与癌旁、远癌组织中GPC-3呈差异表达见表1. 癌灶组GPC-3阳性率明显高于远癌和癌旁组(χ2 = 11.455, P = 0.001), 且癌旁组阳性率明显高于远癌组; 癌灶组GPC-3表达, 强阳性16例(44.4%), 中等阳性7例(19.4%), 弱阳性6例(16.7%); 癌旁组强阳性1例(6.7%), 中等阳性5例(33.3%), 弱阳性9例(60%); 癌灶GPC-3表达明显高于远癌和癌旁组(Fisher值 = 21.169, P = 0.000), 癌旁组强度也明显高于远癌组.
| 分组 | GPC-3阳性率(%) | χ2值 | P值 | GPC-3表达强度 | Fisher值 | P值 | |||
| - | + | ++ | +++ | ||||||
| 远癌组织 | 0.0 | 36 | 0 | 0 | 0 | ||||
| 癌旁组织 | 41.7 | 18.947 | 0.000 | 21 | 9 | 5 | 1 | 19.558 | 0.000 |
| 癌灶组织 | 80.6 | 48.558 | 0.000 | 7 | 6 | 7 | 16 | 53.125 | 0.000 |
GPC-3在癌灶组织的阳性率为80.6%, 其表达强度与肿瘤的分化程度、肿瘤数目、HBsAg、AFP和GGT间的关系, 经确切概率法分析, 各组间均未见明显的统计学差异, 而与肿瘤大小之间存在统计学的差异(Fisher值 = 10.272, P = 0.010, 表2).
| 分组 | n | GPC-3表达阳性率n(%) | GPC-3表达强度 | Fisher值 | P值 | |||
| - | + | ++ | +++ | |||||
| 分化程度 | ||||||||
| 高 | 7 | 5(71.4) | 2 | 1 | 1 | 3 | ||
| 中 | 24 | 20(83.3) | 4 | 4 | 6 | 10 | 0.966 | 0.931 |
| 低 | 5 | 4(80.0) | 1 | 1 | 0 | 3 | 1.405 | 1.000 |
| 肿瘤数目 | ||||||||
| 单发 | 30 | 24(80.0) | 6 | 5 | 7 | 12 | 2.012 | 0.631 |
| 多发 | 6 | 5(83.3) | 1 | 1 | 0 | 4 | ||
| HBsAg | ||||||||
| 阳性 | 31 | 25(80.6) | 6 | 6 | 5 | 14 | 2.109 | 0.709 |
| 阴性 | 5 | 4(80.0) | 1 | 0 | 2 | 2 | ||
| 肿瘤直径(cm) | ||||||||
| ≥5 | 14 | 8(57.1) | 6 | 0 | 3 | 5 | 10.272 | 0.010 |
| <5 | 22 | 21(95.4) | 1 | 6 | 4 | 11 | ||
| 与GGT关系 | ||||||||
| <50 U/L | 17 | 13(76.5) | 5 | 4 | 3 | 6 | 3.038 | 0.422 |
| >50 U/L | 19 | 16(84.2) | 2 | 2 | 4 | 10 | ||
| 与AFP关系 | ||||||||
| <200 μg/L | 18 | 14(77.8) | 4 | 5 | 4 | 5 | 5.061 | 0.166 |
| >200 μg/L | 18 | 15(83.3) | 3 | 1 | 3 | 11 | ||
GPC-3属于硫酸类肝素糖蛋白聚糖家族, 以糖基化磷脂酰肌醇结合到细胞表面[5]. GPC-3蛋白C端与糖基化磷脂酰肌醇共价结合连接于细胞膜上, N端游离于细胞外, 其内由多个二硫键连接, 分子呈球形立体结构. GPC-3核心蛋白含有由14半胱氨酸残基构成的特征性保守序列, 该序列主要分布在核心蛋白中央区域, 其GAG侧链为肝素及硫酸乙酰肝素, 插入位点限在羧基末端的50个氨基酸残基之内. 蛋白分子结构在第358位精氨酸和359位丝氨酸处可被酶切分成2个亚基: 40 kDa的N端蛋白(可溶性)和30 kDa的C端蛋白(与包膜结合). 外显子中存在点缺失或点突变, 导致GPC-3功能丧失. 他的过表达是HCC形成过程中的早期事件, 影响多种信号传导途径, 经多聚阴离子GAG侧链或核心蛋白与Wnt、IGF-Ⅱ和转化酶等共同作用, 参与肝细胞的发生、发展过程, 与肝细胞恶性转化关系密切[8-10].
具有癌胚性质的GPC-3蛋白表达呈棕黄色, 在HCC的癌灶组织中呈巢状分布, 深染, 存在于细胞质和细胞膜, 而对应癌周组织GPC-3阳性表达, 主要位于胞质. HCC组织的不同部分, GPC-3表达存在明显差异. 本研究以免疫组织化学法同步分析了人HCC、癌旁和远癌组织GPC-3表达, 结果显示HCC组织中GPC-3阳性表达明显高于癌周, 特别是远癌组织, 说明肝癌组织GPC-3表达差异, 十分利于良、恶性肝病的鉴别诊断[5,11-12].
HCC组织中核酸代谢旺盛, 癌灶和癌周组织中总RNA存在梯度分布, 可能与HCC组织的侵袭生长与新血管生成密切相关[13-14]. 逆转录巢式聚合酶链反应扩增分析人HCC组织GPC-3 mRNA, 结果显示癌组织表达率为74.8%, 而非肝肿瘤组织仅3.2%, 且与甲胎蛋白(alpha-fetoprotein, AFP)表达无明显相关性, 说明GPC-3 mRNA分析有助于HCC诊断和良恶性肝病的鉴别. HCC模型动态研究肝细胞癌变过程中肝GPC-3 mRNA, 其阳性率逐渐升高, 在癌变肝组织达100%. 人HCC组织GPC-3 mRNA高表达, 他可作为HCC早期诊断敏感性高、特异性强的分子标志物[15].
AFP诊断HCC是目前公认的肿瘤标志物, 但其阳性率仅为70%左右, 其假阴性率达30%, 不利于HCC的早期诊断和小肝癌的发现. 且AFP轻度升高与良性肝病或非肝肿瘤难以区分[16]. GPC-3表达与AFP和γ-谷氨酰基移换酶无明显相关, 联检利于临床上提高诊断HCC的敏感性和特异性. HCC组织GPC-3 mRNA表达明显异常, 且特异性较高. 采用灵敏度高, 特异性强的分析技术探测患者HCC发生相关基因标志, 并结合癌细胞表达的特异性微量蛋白检测, 可早期诊断HCC、监测HCC发生或术后复发. 单克隆抗体能够特异性的识别GPC-3, 可开发新的方便的临床实用方法, 另也可基于单克隆抗体基础上开发新的分子靶向治疗[17]. 随着对GPC-3的深入研究, 将有助于HCC的早期发现和揭示肝细胞癌变的分子机制.
HCC是全球最常见的恶性肿瘤之一, 每年有50余万新发病例, 其中50%在中国. HCC发生发展具有多病因、多中心和多阶段的特征, 肝炎病毒感染引起肝脏慢性炎症是其主要发病背景, HCC的早诊早治至关重要.
樊红, 副教授, 东南大学医学院发育与疾病相关基因教育部重点实验室
GPC-3过表达是HCC形成过程中的早期事件, 影响多种信号传导途径, 与Wnt、IGF-Ⅱ和转化酶等共同作用, 参与肝癌细胞的发生、发展过程, 与肝细胞恶性转化关系密切, 已成为HCC早期诊断的研究热点.
癌组织GPC-3表达率较高, 而非肝肿瘤组织仅在5%以下, 且与AFP表达无相关性. 本研究进行GPC-3 mRNA分析有助于HCC诊断和良恶性肝病的鉴别.
本研究对GPC-3的深入研究, 将有助于HCC的早期发现和揭示肝细胞癌变的分子机制, 并可成为HCC基因治疗的有利靶点.
本文研究了肝癌组织磷脂酰肌醇蛋白多糖-3的表达及其临床病理学特征, 有一定的科学性、创新性和临床价值.
编辑:李瑞敏 电编:何基才
| 1. | Raza SA, Clifford GM, Franceschi S. Worldwide variation in the relative importance of hepatitis B and hepatitis C viruses in hepatocellular carcinoma: a systematic review. Br J Cancer. 2007;96:1127-1134. [PubMed] [DOI] |
| 2. | Kittaka N, Takemasa I, Takeda Y, Marubashi S, Nagano H, Umeshita K, Dono K, Matsubara K, Matsuura N, Monden M. Molecular mapping of human hepatocellular carcinoma provides deeper biological insight from genomic data. Eur J Cancer. 2008;44:885-897. [PubMed] [DOI] |
| 3. | Block TM, Marrero J, Gish RG, Sherman M, London WT, Srivastava S, Wagner PD. The degree of readiness of selected biomarkers for the early detection of hepatocellular carcinoma: notes from a recent workshop. Cancer Biomark. 2008;4:19-33. [PubMed] |
| 5. | Baumhoer D, Tornillo L, Stadlmann S, Roncalli M, Diamantis EK, Terracciano LM. Glypican 3 expression in human nonneoplastic, preneoplastic, and neoplastic tissues: a tissue microarray analysis of 4,387 tissue samples. Am J Clin Pathol. 2008;129:899-906. [PubMed] [DOI] |
| 8. | Shirakawa H, Kuronuma T, Nishimura Y, Hasebe T, Nakano M, Gotohda N, Takahashi S, Nakagohri T, Konishi M, Kobayashi N. Glypican-3 is a useful diagnostic marker for a component of hepatocellular carcinoma in human liver cancer. Int J Oncol. 2009;34:649-656. [PubMed] |
| 9. | Cheng W, Tseng CJ, Lin TT, Cheng I, Pan HW, Hsu HC, Lee YM. Glypican-3-mediated oncogenesis involves the Insulin-like growth factor-signaling pathway. Carcinogenesis. 2008;29:1319-1326. [PubMed] [DOI] |
| 10. | Lai JP, Sandhu DS, Yu C, Han T, Moser CD, Jackson KK, Guerrero RB, Aderca I, Isomoto H, Garrity-Park MM. Sulfatase 2 up-regulates glypican 3, promotes fibroblast growth factor signaling, and decreases survival in hepatocellular carcinoma. Hepatology. 2008;47:1211-1222. [PubMed] [DOI] |
| 11. | Man XB, Tang L, Zhang BH, Li SJ, Qiu XH, Wu MC, Wang HY. Upregulation of Glypican-3 expression in hepatocellular carcinoma but downregulation in cholangiocarcinoma indicates its differential diagnosis value in primary liver cancers. Liver Int. 2005;25:962-966. [PubMed] [DOI] |
| 12. | Lü ZL, Luo DZ, Wen JM. Expression and significance of tumor-related genes in HCC. World J Gastroenterol. 2005;11:3850-3854. [PubMed] |
| 13. | Coston WM, Loera S, Lau SK, Ishizawa S, Jiang Z, Wu CL, Yen Y, Weiss LM, Chu PG. Distinction of hepatocellular carcinoma from benign hepatic mimickers using Glypican-3 and CD34 immunohistochemistry. Am J Surg Pathol. 2008;32:433-444. [PubMed] [DOI] |
| 14. | Ligato S, Mandich D, Cartun RW. Utility of glypican-3 in differentiating hepatocellular carcinoma from other primary and metastatic lesions in FNA of the liver: an immunocytochemical study. Mod Pathol. 2008;21:626-631. [PubMed] [DOI] |
| 15. | Jia HL, Ye QH, Qin LX, Budhu A, Forgues M, Chen Y, Liu YK, Sun HC, Wang L, Lu HZ. Gene expression profiling reveals potential biomarkers of human hepatocellular carcinoma. Clin Cancer Res. 2007;13:1133-1139. [PubMed] [DOI] |
| 16. | Filmus J, Capurro M. Glypican-3 and alphafetoprotein as diagnostic tests for hepatocellular carcinoma. Mol Diagn. 2004;8:207-212. [PubMed] [DOI] |
| 17. | Nakano K, Orita T, Nezu J, Yoshino T, Ohizumi I, Sugimoto M, Furugaki K, Kinoshita Y, Ishiguro T, Hamakubo T. Anti-glypican 3 antibodies cause ADCC against human hepatocellular carcinoma cells. Biochem Biophys Res Commun. 2009;378:279-284. [PubMed] [DOI] |