修回日期: 2009-07-22
接受日期: 2009-07-27
在线出版日期: 2009-08-18
Barrett's食管(Barrett's esophagus, BE)是指食管内膜发生化生, 鳞状上皮被柱状上皮取代, 他是食管腺癌最重要的危险因素. 随着食管腺癌在西方国家的发病率迅速升高, BE日益受关注. 过去几年里, BE领域取得显著的进步, 本文主要针对其诊断标准、内镜诊断及新的内镜成像技术等方面作一综述.
引文著录: 卢秀珊, 王成文. Barrett's食管的诊断进展. 世界华人消化杂志 2009; 17(23): 2391-2395
Revised: July 22, 2009
Accepted: July 27, 2009
Published online: August 18, 2009
Barrett's esophagus is a metaplastic change in esophageal lining, characterized by the replacement of normal squamous epithelium with columnar epithelium. Barrett's esophagus is associated with a high risk of esophageal adenocarcinoma. As the incidence of esophageal adenocarcinoma has risen dramatically in developed countries, the research on Barrett's esophagus is attracting increasing attention. In this article, we will review the recent advances in the diagnosis of Barrett's esophagus.
- Citation: Lu XS, Wang CW. Advances in the diagnosis of Barrett's esophagus. Shijie Huaren Xiaohua Zazhi 2009; 17(23): 2391-2395
- URL: https://www.wjgnet.com/1009-3079/full/v17/i23/2391.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i23.2391
Barrett's食管(Barrett's esophagus, BE)是食管腺癌的癌前病变, 其癌变的危险性较一般人群高出30-125倍. 近20年来, 食管腺癌的发病率增长迅速, 据调查[1], 1975-2001年美国食管腺癌的发病率上升接近6倍, 超过了黑色素瘤、前列腺癌和乳腺癌, 其中大部分由BE发展而来. BE在西方白种人中发病率较高, 其中欧洲约1%-4%, 美国约5%-12%, 虽然黑人及亚洲人中相对少见, 但近年来的报道有所增加, 其中2项大型的前瞻性研究显示, 日本人的总体发病率在0.9%-1.2%[2]. BE和食管腺癌的发病率不断升高, 如何尽早诊断和发现早期癌变是目前面临的最大挑战.
1950年英国心胸外科医生Norman Barrett首先提出BE, 并以他的名字命名(又称Barrett病), 其后的近60年里, BE的定义一直是大家争论的焦点, 近年来使用最普遍的是, 胃食管连接部的鳞状上皮被柱状上皮取代, 并经内镜多处活检证实肠化(以杯状细胞为标志)的存在以确诊, 但现在部分国家, 如日本、英国等, 其指南已不要求必须活检证实肠化才可诊断为BE[3-4].
目前, 国际上主要存在2种观点: 一种是主张只有活检发现杯状细胞才诊断BE, 因为定义BE的目的是对这种食管腺癌危险因子建立一种标准的识别方法, 以便于诊断、治疗和研究, 而伴有肠化的癌变风险最高, Cameron et al[5]研究胃食管连接部的小腺癌, 发现86%的腺癌伴有肠化, 再者严格定义BE可减少因过度诊断而增加患者经济与心理负担. 另一种观点则不主张限定只有活检发现杯状细胞才诊断BE. 其依据是: (1)即使没有发现杯状细胞, 仍然很容易辨认柱状上皮的特点并显示出肠化的生理机能, 如表达DAS-1, CDX-2, 肠黏蛋白3(mucin-3, MUC-3)等[6-8], 这些肠转录因子、肠MUC基因等在肠化、高度不典型增生的BE及BE相关腺癌组织中呈现显著高表达; (2)即使没有发现杯状细胞, 食管柱状上皮也可能发展为腺癌, Kelty et al[9]随访712例BE患者8-20年, 发展为腺癌的为4.1%, 其中伴有肠化的为4.5%, 未发现肠化的为3.6%, 两者的癌变风险几乎相同. 事实上既无对照证据, 也无基础研究表明BE进展为肿瘤与杯状细胞有关; (3)杯状细胞呈灶性分布, 其检出率与活检的次数和部位、BE的长度、样本误差等有关, 如Janes et al[10]在首次内镜检查发现可疑短节段BE(short-segment Barrett's esophagus, SSBE)但病理未发现肠化的患者中, 再次行内镜活检有23.2%患者新发现肠化. Oberg et al[11]研究发现, 1-2 cm长度短节段BE肠化的检出率是30.5%, 而6 cm以上的长节段BE(long-segment Barrett's esophagus, LSBE)检出率接近90%; 另Reid et al[12]的研究也表明间隔2 cm行活检可导致超过50%的癌症漏诊率. 为了统一标准, 2006-2008年来自不同国家的多位专家经反复讨论和投票, 制定了胃食管反流病的最新全球定义-蒙特利尔定义和分类[13], 其中引入了一个新概念: 内镜疑似食管化生(endoscopic suspected esophageal metaplasia, ESEM), 当ESEM活检发现柱状上皮时, 应诊断为BE, 并具体说明是否存在肠型化生, 同时明确了有肠上皮化生的长节段BE是食管腺癌的重要危险因素. 这将有助于不同国家的临床医师讨论同一种疾病, 使不同研究间的患者具有可比性.
目前国际上认可的最常用、最可靠的手段仍是传统的内镜结合病理组织学检查.
BE的内镜下特征是齿状线水平不再与胃食管连接部(gastro-esophageal junction, GEJ)一致, 从而导致食管远端出现内镜下所见的橘红色黏膜, 呈全周型、舌型或岛状. 可见准确判断齿状线和GEJ的位置非常重要. 通常, 齿状线是比较容易识别的, 因为2种上皮颜色不同, 正常的鳞状上皮呈粉红色, 而柱状上皮为橘红色. 在BE中, 橘红色的柱状上皮凸出于管状食管. 但GEJ的解剖位置却不那么容易识别, 得到最多认可的是GEJ位于纵行胃皱襞近端的边缘. 另外还有以食管下端栅状血管网为标志的, 日本专家认为, 发生BE时, 尽管柱状上皮代替了鳞状上皮, 但其下方的血管网仍为栅状, 以栅状血管的末端为GEJ[3]. 但区别真正的柵状血管和其他GEJ以下的黏膜下血管纹理有时是很困难的, 而且不是所有患者都可以在内镜下清楚地看到柵状血管. 其他还有管状食管末段和囊样胃腔的交界部位、食管末端收缩处等, 但这些方法没有第一种的重复性好. 总体来说GEJ的识别只有中度可重复性.
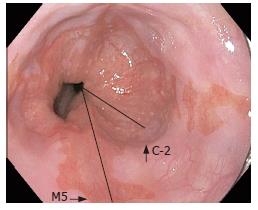
传统的BE根据累及黏膜的长度分为长节段和短节段BE. 另外有研究发现20%内镜阴性的胃食管反流病(gastroesophageal reflex disease, GERD)患者在齿状线处活检发现有肠化[14], 而10%-17%既无反流症状, 也无内镜可疑BE表现的患者活检也存在肠化[15]. 这些患者的齿状线较直, 且没有移位, 但病理证实有肠化, 有学者称之为超短节段BE, 目前对这部分病灶了解较少, 其病因、发病机制等尚不清楚, 但其不典型增生发生率似乎较少[16]. 有学者认为BE的长度可能与患癌风险有关, 如Gopal et al[17]通过多个中心共309名BE患者的研究发现SSBE不典型增生发生率为9%, LSBE达23%, 而且长度每增加1 cm, 不典型增生的风险增加14%. 但也有学者认为SSBE及LSBE两者患食管腺癌的风险没有显著的区别, Rudolph et al[18]研究发现, 长度增加5 cm, 癌变风险只增加1.7倍, 两者无明显线性关系. 所以目前仍缺乏充分有效的证据说明两者的关系, 这种单纯按长度的分类方法尚无明确的病理组织学意义. 因此, Sharma et al[19]提出了BE布拉格C或M分类系统, 该系统包括对BE累及全管周的长度(C)和累及的最大长度(M)进行评估(图1), 累及食管远端全周的长度为2 cm以C-2表示, 累及最大长度为5 cm则以M-5表示, 则布拉格分类为C2M5节段. 其C和M的可信度分别是0.95及0.94, 对于≥1 cm的BE内镜下识别的总体可信度达0.72, 在目前的诊断技术水平已显示出较好的可重复性. 遗憾的是, 这一分类系统不适用于邻近的岛状及<1 cm的超短节段BE.
准确地活检取材对监测随访其癌变潜能是有重要意义的. 如何取活检, 不同地区也各有差异, 现国际上普遍采用四象限方法, 即在GEJ及齿状线之间每隔1-2 cm行活检. 但肠化和不典型增生均呈灶性分布, 间隔2 cm活检很容易出现漏诊, 一项最近的回顾性研究[20]中296个患者行内镜检查, 其中125例为BE, 取8处活检的杯状细胞检出率为68%, 而取4处分析的仅为35%, 因此对疑有异型增生或癌变的有必要间隔1 cm取更多活检. 该法要求取材组织多, 而食管下段黏膜下血管丰富, 活检时出血多, 会加大操作难度而且有并发大出血的危险, 有人提出活检前在BE黏膜表面喷洒稀释的肾上腺素, 有止血效果, 可提高活检时的可见度[21]. 鉴于四象限活检存在耗时长、费用大、操作难度高等不足, 我国一般行靶向活检, 即根据检查者的经验在可疑柱状上皮的区域取活检. 但有研究提示系统的四象限活检中不典型增生及早期癌的检出率比非系统活检高[22].
近年来BE的诊断出现大量新技术, 并且很多的技术报道对诊断BE、不典型增生和早期癌有高度敏感性及特异性.
严格来说, 色素内镜是一种老的技术, 常用的染色剂有1.5%-4% Lugol碘液、1%-2%亚甲蓝或靛卡红、1.5%乙酸等. 其中亚甲蓝可以被杯状细胞吸收使肠化区被染成蓝色, 所以被认为最有希望提高肠化及不典型增生的检出率[23-24], 但近年也有大量的前瞻性对照研究发现其相对于四象限活检并没有明显优势[25-26]. 目前染色剂被结合放大内镜一起使用, 对照结果显示有助于检测肠化和不典型增生, 如Réaud et al[27]和Guelrud et al[28]分别研究发现其检测肠化敏感性达95.5%以上, 而特异性有所争议, 他们的实验结果分别是42.9%和88.7%, 但样本量少, 尚不清楚临床应用中的重复性如何.
胶囊内镜自2001年通过FDA认证以来, 其临床应用日益广泛, 但目前仍主要用于小肠疾病, 如小肠出血、肿瘤、CD、遗传性息肉综合征、乳糜泻等, 其敏感性和特异性基本可接受, 临床应用于食管疾病仍是一项新技术, 他最大的缺点是不能活检, 如果BE就是食管柱状上皮化生, 那他有潜力为我们提供一种非侵入性检查手段. 在早期对少数患者的研究中发现其具有高敏感性, 但是随后的大样本研究证明实际上敏感性并不高[29-30], 其中一项90名患者的前瞻性研究发现食管胶囊内镜诊断BE的敏感性及特异性分别只有67%和84%[29]. 而且价格昂贵, 仍存技术问题, 例如记录中断、传输失败等, 以及临床应用的问题, 如胶囊滞留等.
窄频带成像(narrow-band imaging, NBI)的原理是将传统电子内镜中的3个宽谱滤光片换成了特殊优化的窄谱滤光片, 使电子内镜的红/绿/蓝光源的波谱范围相对变窄, 波长相对变短, 而且3种光源的构成比例中以蓝光为主, 蓝光的波长短, 其他组织吸收少, 却能被血红蛋白选择性地吸收, 所以能更清楚地显示黏膜浅表血管, 使血管系统与周围组织的对比性明显增强, 在一定程度上具有染色内镜相似的效果, 而且操作灵活、方便, 与传统内镜之间可随意切换, 对病变部位可重复观察, 与高分辨内镜联合应用可更好地观察黏膜. 与普通内镜相比, NBI对齿状线、GEJ、栏栅状血管等结构显示更加清晰, 而肠化也有特征性的脑回样黏膜、常青藤或DNA样毛细血管, 高度不典型增生和早期癌则往往黏膜结构不规则, 血管增多、扩张[31]. Sharma et al[32]对NBI的研究, 在51名BE患者中发现7名患者有高度不典型增生, 敏感度达100%, 特异性达98.7%; Singh et al[33]通过前瞻对照研究得出, NBI结合放大内镜诊断BE的敏感性达88.9%, 特异性达94.8%. 在我国, NBI已开始投入临床使用, 但目前尚未有国际上统一的NBI下黏膜及血管形态结构的分类标准.
人体组织内含有很多能发射荧光的物质, 如胶原、核黄素等, 自体荧光成像的原理就是通过向组织发出一定波长的激光, 激发并探测组织的自身荧光光谱及成像, 从而获得组织内部物理和化学的特性, 由此可鉴别不同的组织, 正常组织在荧光图像上显示为蓝色, BE为绿色, 大多数癌组织为暗红色, 这些特点有利于诊断BE中的不典型增生和早期癌[34]. 但是由于食管炎症及新生上皮也表现为红色, 所以导致假阳性率太高, 一项20例BE患者的自体荧光成像研究[35]发现不典型增生区域的敏感度为100%, 但是有40%假阳性率.
共聚焦激光显微内镜技术(laser confocal microscopy, CLE)是将一个小型的共聚焦激光显微镜安装于传统的电子内镜头端, 其成像原理是由激光器发出激光束, 激发组织中人造的荧光物质使之产生不同方向的荧光, 利用光产生干涉图像并将其数字化, 从而构成检测区域的三维图像. 由于杯状细胞和癌细胞在CLE下均有显著特点, 所以可用于识别肠化和早期癌. 我国有人对CLE进行了初步的研究[36], 以10%的荧光素钠静注作对比剂后检查21名BE患者, 其敏感度为 95%, 特异度为90%. 然而Pohl et al对38位BE患者研究发现CLE检测BE中不典型增生的敏感性只有75%, 特异性为88.8%-91.0%[37]. 由于荧光素钠不能进入细胞核, 胞核不显示, 所以CLE的缺点是不易区分低度和高度不典型增生.
光学相干断层摄影技术(optical coherence tomography, OCT)的原理是利用近红外低相干光照射到待测组织, 依据光的相干性产生干涉来测量光反射所经过的距离而成像, 收集的信号经处理后可得到组织断面的二维或三维图像, 是一种快速、实时的活体组织深层显微结构的非侵入性成像方法, 虽然OCT跟超声内镜非常类似, 但其分辨率极高, 几乎与光学显微镜相当. 自1991年研发出来, OCT用于眼球、心脏病及早期癌等许多研究领域, 并且部分已经应用于临床, 而胃肠道检查的应用仍处于研究阶段. Wang et al[38]对98份食管远端的离体组织进行研究, 发现高速成像的傅立叶域OCT技术对BE的诊断具有高度敏感性、特异性及准确性, 而且检测不典型增生的敏感性、特异性分别达92%和80%. 其缺点在于所能探及的组织深度浅, 仅1-2 mm, 且每次成像范围小, 不利于大范围的检查.
随着对BE的逐步深入研究, 其诊断标准几经修改, 最佳可操作的标准应明了、重复性好, 而且与食管腺癌的风险相关, 至于新定义和分类系统是否符合以上标准, 还有待临床验证. 目前经内镜活检的组织病理评估不典型增生和癌症风险仍得不到满意的效果, 新的内镜成像技术的初步研究显示其对肠化、不典型增生的敏感性及特异性高, 有较好的临床应用前景.
BE是食管腺癌的癌前病变, 其癌变的危险性较一般人群高出30-125倍. 在我国BE发病率不如西方白种人高, 但近年来报道的病例数越来越多. 目前BE诊断标准的分歧主要是是否需要伴有肠化, 其诊断手段主要是靠内镜结合组织病理, 而新的内镜成像技术不断涌现为提高BE的诊断率开拓了广阔的前景.
吕宾, 教授, 浙江中医学院附属医院(浙江省中医院、浙江省东方医院)消化科.
近年来出现大量新的内镜成像技术, 如窄频带成像、自体荧光成像、共聚焦激光显微内镜技术、光学相干断层摄影技术等, 初步研究显示他们不仅有助于提高BE的诊断率, 而且对肠化、不典型增生及早期癌的敏感性及特异性高, 有可能在不久的将来会应用于临床.
Shaheen et al详细陈述了BE的临床表现、流行病学、形成的风险因素、发病和恶化的机制、不典型增生的内镜检测以及治疗等新进展, 并且探讨未来的研究方向. Sharma et al通过收集29位患者的电子内镜录像, 让不同国际小组的内镜医师根据布拉格C&M标准进行识别和分类, 结果显示出较好的可重复性, 此分类系统弥补了传统的内镜诊断和分类方法的可重复性差、病理组织学意义相关性差等缺点.
本文从BE的诊断标准、内镜诊断、分类和活检方法等方面逐一阐述, 给出近年来国外诊断方面较新的观点, 有助于指导临床; 另外详细介绍了几种新的内镜成像技术的原理及近年这些技术在诊断BE、肠化和不典型增生的最新研究成果.
1 内镜疑似食管化生(ESEM):专家建议内镜检查发现异常, 提示Barrett's食管, 但确诊尚待组织学证实的用ESEM表示, 从而将内镜下诊断食管柱状上皮化生与病理证实有食管柱状上皮化生两者用不同的名称区分.
2 自体荧光成像: 人体组织内自身含有很多能发射荧光的物质, 通过向组织发出一定波长的激光, 激发并探测组织的自身荧光光谱及成像, 从而获得组织内部物理和化学特性, 而同一组织的不同部位, 其生化成分与结构基本相同, 由此可鉴别不同的组织.
3 光学相干断层摄影技术: 利用近红外低相干光照射到待测组织, 依据光的相干性产生干涉, 测量光反射所经过的距离而成像, 收集的信号经处理后可得到组织断面的二维或三维图像.
本文内容较全面, 文献资料较新, 综述层次清楚, 可读性较强, 具有临床参考价值.
编辑:李军亮 电编:吴鹏朕
| 1. | Pohl H, Welch HG. The role of overdiagnosis and reclassification in the marked increase of esophageal adenocarcinoma incidence. J Natl Cancer Inst. 2005;97:142-146. [PubMed] |
| 2. | Hongo M. Review article: Barrett's oesophagus and carcinoma in Japan. Aliment Pharmacol Ther. 2004;20 Suppl 8:50-54. [PubMed] [DOI] |
| 4. | Playford RJ. New British Society of Gastroenterology (BSG) guidelines for the diagnosis and management of Barrett's oesophagus. Gut. 2006;55:442. [PubMed] [DOI] |
| 5. | Cameron AJ, Souto EO, Smyrk TC. Small adenocarcinomas of the esophagogastric junction: association with intestinal metaplasia and dysplasia. Am J Gastroenterol. 2002;97:1375-1380. [PubMed] [DOI] |
| 6. | Odze RD. Unraveling the mystery of the gastroesophageal junction: a pathologist's perspective. Am J Gastroenterol. 2005;100:1853-1867. [PubMed] [DOI] |
| 7. | Phillips RW, Frierson HF Jr, Moskaluk CA. Cdx2 as a marker of epithelial intestinal differentiation in the esophagus. Am J Surg Pathol. 2003;27:1442-1447. [PubMed] [DOI] |
| 8. | Glickman JN, Shahsafaei A, Odze RD. Mucin core peptide expression can help differentiate Barrett's esophagus from intestinal metaplasia of the stomach. Am J Surg Pathol. 2003;27:1357-1365. [PubMed] [DOI] |
| 9. | Kelty CJ, Gough MD, Van Wyk Q, Stephenson TJ, Ackroyd R. Barrett's oesophagus: intestinal metaplasia is not essential for cancer risk. Scand J Gastroenterol. 2007;42:1271-1274. [PubMed] |
| 10. | Jones TF, Sharma P, Daaboul B, Cherian R, Mayo M, Topalovski M, Weston AP. Yield of intestinal metaplasia in patients with suspected short-segment Barrett's esophagus (SSBE) on repeat endoscopy. Dig Dis Sci. 2002;47:2108-2111. [PubMed] [DOI] |
| 11. | Oberg S, Johansson J, Wenner J, Johnsson F, Zilling T, von Holstein CS, Nilsson J, Walther B. Endoscopic surveillance of columnar-lined esophagus: frequency of intestinal metaplasia detection and impact of antireflux surgery. Ann Surg. 2001;234:619-626. [PubMed] [DOI] |
| 12. | Reid BJ, Blount PL, Feng Z, Levine DS. Optimizing endoscopic biopsy detection of early cancers in Barrett's high-grade dysplasia. Am J Gastroenterol. 2000;95:3089-3096. [PubMed] [DOI] |
| 13. | Vakil N, van Zanten SV, Kahrilas P, Dent J, Jones R. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol. 2006;101:1900-1920; quiz 1943. [PubMed] |
| 14. | Spechler SJ, Zeroogian JM, Antonioli DA, Wang HH, Goyal RK. Prevalence of metaplasia at the gastro-oesophageal junction. Lancet. 1994;344:1533-1536. [PubMed] [DOI] |
| 15. | Wallner B, Sylvan A, Stenling R, Janunger KG. The Z-line appearance and prevalence of intestinal metaplasia among patients without symptoms or endoscopical signs indicating gastroesophageal reflux. Surg Endosc. 2001;15:886-889. [PubMed] [DOI] |
| 16. | Morales TG, Camargo E, Bhattacharyya A, Sampliner RE. Long-term follow-up of intestinal metaplasia of the gastric cardia. Am J Gastroenterol. 2000;95:1677-1680. [PubMed] [DOI] |
| 17. | Gopal DV, Lieberman DA, Magaret N, Fennerty MB, Sampliner RE, Garewal HS, Falk GW, Faigel DO. Risk factors for dysplasia in patients with Barrett's esophagus (BE): results from a multicenter consortium. Dig Dis Sci. 2003;48:1537-1541. [PubMed] [DOI] |
| 18. | Rudolph RE, Vaughan TL, Storer BE, Haggitt RC, Rabinovitch PS, Levine DS, Reid BJ. Effect of segment length on risk for neoplastic progression in patients with Barrett esophagus. Ann Intern Med. 2000;132:612-620. [PubMed] |
| 19. | Sharma P, Dent J, Armstrong D, Bergman JJ, Gossner L, Hoshihara Y, Jankowski JA, Junghard O, Lundell L, Tytgat GN. The development and validation of an endoscopic grading system for Barrett's esophagus: the Prague C & M criteria. Gastroenterology. 2006;131:1392-1399. [PubMed] [DOI] |
| 20. | Harrison R, Perry I, Haddadin W, McDonald S, Bryan R, Abrams K, Sampliner R, Talley NJ, Moayyedi P, Jankowski JA. Detection of intestinal metaplasia in Barrett's esophagus: an observational comparator study suggests the need for a minimum of eight biopsies. Am J Gastroenterol. 2007;102:1154-1161. [PubMed] [DOI] |
| 21. | Pohl J, Nguyen-Tat M, Manner H, Pech O, van Weyenberg SJ, Ell C. "Dry biopsies" with spraying of dilute epinephrine optimize biopsy mapping of long segment Barrett's esophagus. Endoscopy. 2008;40:883-887. [PubMed] [DOI] |
| 22. | Abela JE, Going JJ, Mackenzie JF, McKernan M, O'Mahoney S, Stuart RC. Systematic four-quadrant biopsy detects Barrett's dysplasia in more patients than nonsystematic biopsy. Am J Gastroenterol. 2008;103:850-855. [PubMed] [DOI] |
| 23. | Ormeci N, Savas B, Coban S, Palabiyikoğlu M, Ensari A, Kuzu I, Kursun N. The usefulness of chromoendoscopy with methylene blue in Barrett's metaplasia and early esophageal carcinoma. Surg Endosc. 2008;22:693-700. [PubMed] [DOI] |
| 24. | Gossner L, Pech O, May A, Vieth M, Stolte M, Ell C. Comparison of methylene blue-directed biopsies and four-quadrant biopsies in the detection of high-grade intraepithelial neoplasia and early cancer in Barrett's oesophagus. Dig Liver Dis. 2006;38:724-729. [PubMed] [DOI] |
| 25. | Lim CH, Rotimi O, Dexter SP, Axon AT. Randomized crossover study that used methylene blue or random 4-quadrant biopsy for the diagnosis of dysplasia in Barrett's esophagus. Gastrointest Endosc. 2006;64:195-199. [PubMed] [DOI] |
| 26. | Horwhat JD, Maydonovitch CL, Ramos F, Colina R, Gaertner E, Lee H, Wong RK. A randomized comparison of methylene blue-directed biopsy versus conventional four-quadrant biopsy for the detection of intestinal metaplasia and dysplasia in patients with long-segment Barrett's esophagus. Am J Gastroenterol. 2008;103:546-554. [PubMed] [DOI] |
| 27. | Reaud S, Croue A, Boyer J. Diagnostic accuracy of magnifying chromoendoscopy with detection of intestinal metaplasia and dysplasia using acetic acid in Barrett's esophagus. Gastroenterol Clin Biol. 2006;30:217-223. [PubMed] [DOI] |
| 28. | Guelrud M, Herrera I, Essenfeld H, Castro J. Enhanced magnification endoscopy: a new technique to identify specialized intestinal metaplasia in Barrett's esophagus. Gastrointest Endosc. 2001;53:559-565. [PubMed] [DOI] |
| 29. | Lin OS, Schembre DB, Mergener K, Spaulding W, Lomah N, Ayub K, Brandabur JJ, Bredfeldt J, Drennan F, Gluck M. Blinded comparison of esophageal capsule endoscopy versus conventional endoscopy for a diagnosis of Barrett's esophagus in patients with chronic gastroesophageal reflux. Gastrointest Endosc. 2007;65:577-583. [PubMed] [DOI] |
| 30. | Ramirez FC, Akins R, Shaukat M. Screening of Barrett's esophagus with string-capsule endoscopy: a prospective blinded study of 100 consecutive patients using histology as the criterion standard. Gastrointest Endosc. 2008;68:25-31. [PubMed] [DOI] |
| 31. | Goda K, Tajiri H, Ikegami M, Urashima M, Nakayoshi T, Kaise M. Usefulness of magnifying endoscopy with narrow band imaging for the detection of specialized intestinal metaplasia in columnar-lined esophagus and Barrett's adenocarcinoma. Gastrointest Endosc. 2007;65:36-46. [PubMed] [DOI] |
| 32. | Sharma P, Bansal A, Mathur S, Wani S, Cherian R, McGregor D, Higbee A, Hall S, Weston A. The utility of a novel narrow band imaging endoscopy system in patients with Barrett's esophagus. Gastrointest Endosc. 2006;64:167-175. [PubMed] [DOI] |
| 33. | Singh R, Karageorgiou H, Owen V, Garsed K, Fortun PJ, Fogden E, Subramaniam V, Shonde A, Kaye P, Hawkey CJ. Comparison of high-resolution magnification narrow-band imaging and white-light endoscopy in the prediction of histology in Barrett's oesophagus. Scand J Gastroenterol. 2009;44:85-92. [PubMed] [DOI] |
| 34. | Kara MA, DaCosta RS, Streutker CJ, Marcon NE, Bergman JJ, Wilson BC. Characterization of tissue autofluorescence in Barrett's esophagus by confocal fluorescence microscopy. Dis Esophagus. 2007;20:141-150. [PubMed] [DOI] |
| 35. | Kara MA, Peters FP, Fockens P, ten Kate FJ, Bergman JJ. Endoscopic video-autofluorescence imaging followed by narrow band imaging for detecting early neoplasia in Barrett's esophagus. Gastrointest Endosc. 2006;64:176-185. [PubMed] [DOI] |
| 37. | Pohl H, Rösch T, Vieth M, Koch M, Becker V, Anders M, Khalifa AC, Meining A. Miniprobe confocal laser microscopy for the detection of invisible neoplasia in patients with Barrett's oesophagus. Gut. 2008;57:1648-1653. [PubMed] [DOI] |
| 38. | Wang TD, Triadafilopoulos G, Crawford JM, Dixon LR, Bhandari T, Sahbaie P, Friedland S, Soetikno R, Contag CH. Detection of endogenous biomolecules in Barrett's esophagus by Fourier transform infrared spectroscopy. Proc Natl Acad Sci U S A. 2007;104:15864-15869. [PubMed] [DOI] |