修回日期: 2009-05-14
接受日期: 2009-05-18
在线出版日期: 2009-06-18
目的: 观察Barrett's食管黏膜组织中CDX mRNA和蛋白表达, 观察不同胆汁酸对人食管细胞株Eca-109 CDX2 mRNA表达水平的影响.
方法: 收集内镜下正常食管组织(n = 5), 反流性食管炎(n = 7), Barrett's食管(n = 8)标本. 采用RT-PCR测定CDX1和CDX2 mRNA表达; 实时荧光定量PCR测定CDX2 mRNA表达. 用免疫组织化学染色法对CDX2蛋白进行定位. 人食管癌细胞株Eca-109分别在100、400、1000 μmol/L胆酸(CA), 脱氧胆酸(DCA), 甘胆酸(GC)中培养, 分别在0-24 h收取细胞, 荧光定量PCR测定CDX2 mRNA表达.
结果: CDX2 mRNA在正常食管组织中无表达, 在Barrett's食管组、反流性食管炎组表达增高(9.6411±6.6823, 3.9156±3.6700), 与正常食管组之间比较均存在显著性差异(P = 0.006, 0.025), 但2组之间没有显著性差异(P = 0.133), CDX1在所有食管组织中均无表达. 免疫组织化学染色在Barrett's食管有CDX2蛋白胞核呈特异性染色阳性反应, 反流性食管炎组织CDX2胞质显示细颗粒性染色(假阳性), 正常的食管组织未发现特异性染色. CDX2 mRNA在未加药物处理的Eca-109细胞株中没有表达, 其表达量对DCA、GC、CA显示出时间和剂量依赖性.
结论: CDX2基因异常表达在食管黏膜肠化生过程中可能具有较重要作用, CDX2基因的表达可能是Barrett's食管发生过程的早期事件. 胆汁酸在体外实验上调CDX2基因表达, 通过调节其表达在Barrett's食管发生中起重要作用.
引文著录: 李慧, 帅晓玮, 谢鹏雁, 李江. CDX1/2在人Barrett's食管中的表达以及胆酸对CDX2表达的影响. 世界华人消化杂志 2009; 17(17): 1738-1744
Revised: May 14, 2009
Accepted: May 18, 2009
Published online: June 18, 2009
AIM: To investigate CDX1 and CDX2 expressions in biopsies obtained from patients with reflux esophagitis and Barrett's esophagus and to study the effects of various bile acids on CDX2 mRNA expression in human esophageal cell line (Eca-109).
METHODS: Endoscopic biopsies were obtained at the distal esophagus in patients and classified according to histology: normal squamous mucosa (n = 5), esophagitis mucosa (n = 7), and Barrett's metaplasia (n = 8). Gene expression of CDX1 and CDX2 were measured using reverse transcription polymerase chain reaction (RT-PCR) or quantitative real-time RT-PCR. CDX2 protein expression was assessed immunohistochemically. Human esophageal cell line (Eca-109) was exposed to cell culture for 1-24 h to 100, 400, 1000 μmol/L deoxycholic acid (DCA), cholicacid (CA), and glycocholicacids (GC). CDX2 mRNA expression was determined by quantitative RT-PCR.
RESULTS: CDX2 mRNA expression was significantly higher in Barrett's epithelium (9.6411 ± 6.6823) and reflux esophagitis (3.9156 ± 3.6700), compared with normal esophagus (P = 0.006, 0.025 respectively). There was no significant difference between Barrett's mucosa and reflux esophagits (P = 0.133). CDX1 mRNA was not detected in all esophageal mucosa. There was no CDX2 protein expression in normal squamous esophagus, and nuclear immunoreactivity was seen in Barrett's epithelium. Perinuclear immunoreactivity for CDX2 was detected in reflux esophagitis. CDX2 mRNA expression was absent before bile acid exposure in all cell lines and increased in a dose- and time-dependent pattern with deoxycholic acid (DCA), cholicacid (CA), and glycocholicacids (GC).
CONCLUSION: CDX2 expression is up-regulated in esphagitis and Barrett's esophagus, suggesting a possible onset role for CDX2 in esophagitis-Barrett's metaplasia sequence. Bile acids can evoke high expression of CDX2 in vitro. Bile acids may play an important role in Barrett's metaplasia by influencing the expression of CDX2.
- Citation: Li H, Shuai XW, Xie PY, Li J. Expression of CDX1/2 in patients with Barrett's esophagus and the effects of bile acids on CDX2 expression. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1738-1744
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1738.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1738
尾侧型同源转录因子(caudal type homeobox transcription factor, CDX)是人体肠道中特异表达的核转录因子, 在肠黏膜上皮细胞的发育及保持其形态、结构特征中起着重要作用, 其中CDX1和CDX2在成年人肠黏膜中表达[1]. Barrett's食管(Barrett's esophagus, BE)的特征是食管炎远端鳞状上皮被肠化的柱状上皮替代. 目前认为食管腺癌的发生经历了反流性食管炎→BE→非典型增生→腺癌的过程, 而BE被认为是食管腺癌的癌前病变[4]. 近年来BE食管的发病率有明显升高[5-7]. CDX2异位表达可诱导肠上皮化生[1-3,7], 其在食管黏膜中异位表达与BE发生关系密切. 与不伴有BE的胃食管反流病(gastroesophageal reflux disease, GERD)患者相比, BE患者的食管中有更高浓度的胆酸, 其对BE的发生有重要作用. 本研究用免疫组织化学和实时定量PCR的方法检测BE、反流性食管炎食管标本中CDX表达, 并检测胆酸对人食管癌细胞株Eca-109的CDX2 mRNA表达水平的变化, 探讨CDX在BE发生过程中的作用, 以及胆汁酸对CDX表达的影响.
收集我院消化科胃镜室2007-04/2008 -01进行胃镜检查的患者食管标本. 鼠抗人CDX2 mAb美国BioGenex公司生产. SP试剂盒、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司. 人食管癌细胞株Eca-109购自南京凯基生物公司. 胆酸(CA)、脱氧胆酸(DCA)、甘胆酸(GC)由Sigma公司生产.
1.2.1 标本采集: 全周型BE于胃黏膜皱襞消失处上1 cm取活检, 采用四象限活检法; 其他类型BE及反流性食管炎于内镜观察下病变处取活检; 正常食管黏膜于齿状线上1 cm处取活检. 所取食管标本(n = 20)立即放于液氮保存, 另取正常结肠组织作为阳性对照(n = 3). 经HE染色明确肠化生情况并据此分组, 分为BE组(n = 8)、反流性食管炎组(n = 7)、正常食管组(n = 5)、结肠阳性对照组(n = 3). BE诊断标准根据日本食管炎疾患研究会2000年修订标准[8].
1.2.2 RNA的抽提: 组织总RNA用TRIzol按照试剂说明书操作. 用2 μg RNA、200 U M-MLV行25 μL反应体系逆转录, 以β-actin、CDX2、CDX1特异性引物进行25 μL体系PCR, CDX1引物F: 5'-CGGTGGCAGCGGTAAGAC-3', R: 5'-GATTGTGATGTAACGGCTGTAATG-3'; 退火温度为60 ℃. CDX2引物F: 5'-CAGTCGCTACATCACCATC-3', R: 5'-AGAGTCCACGCTCCTCAT-3'; 退火温度为66 ℃. β-actin引物F: 5'-ACACCTTCTACAATGAGC-3', R: 5'-ACGTCACACTTCATGATG-3'; 退火温度为57 ℃, PCR产物进行20 g/L琼脂糖凝胶电泳. 使用ABI 7300 System进行50 μL体系定量PCR, CDX1引物F: 5'-CGGTGGCAGCGGTAAGAC-3', R: 5'-GATTGTGATGTAACGGCTGTAATG-3'; 探针序列: FAM5'-ACCAAGGACAAGTACCGCGTGGTCTACA-3', TAMRA. β-actin引物F: 5'-ACACCCCAGCCATGTACGTT-3'; R: 5'-CGTCACCGGAGTCCATCAC-3'; 探针: FAM 5'-CTGTGCTATCCCTGTACG-3', TAMRA. CDX2引物F: 5'-CTACATCACCATCCGGAGGAA-3', R: 5'-CTCCTTTGCTCTGCGGTTCT-3'; 探针序列: FAM 5'-CGAGCTAGCCGCCACGCTGG-3' TAMRA. CDX2相对定量值为CDX2定量值/β-actin定量值, CDX1定量值为CDX1定量值/β-actin定量值.
1.2.3 免疫组织化学染色: RT-PCR未发现CDX1的表达, 只进行CDX2免疫组化染色观察. 组织40 g/L中性甲醛溶液固定, 常规石蜡包埋, 切片, 37 ℃过夜烤片, 二甲苯脱蜡, 水化; 30 mL/L过氧化氢甲醇溶液处理10 min, 消除内源性过氧化物酶, PBS洗5 min; 微波法抗原修复: 枸橼酸盐缓冲液(10 μmol/L, pH 6.0)中微波高火2 min, 解冻10 min, 完毕后自然冷却到室温, PBS洗5 min; 正常山羊血清封闭30 min倾去, 不洗; 鼠抗人CDX2 mAb, 4 ℃过夜孵育, PBS洗3 min×3次; 滴加兔抗鼠二抗37 ℃孵育1 h, PBS洗3 min×3次, DAB显色, 苏木素复染, 脱水, 透明, 封片. 正常的结肠组织作为阳性对照, 以不加鼠抗人CDX2 mAb孵育的切片作为阴性对照. 染色细胞核呈现棕黄色颗粒定为CDX2阳性表现, 胞质呈现棕黄色定为假阳性.
1.2.4 细胞培养: 将人食管癌细胞株Eca-109种植于DMEM高糖培养基中, 加入100 g/L小牛血清, 置于50 mL/L CO2, 37 ℃培养箱中培养. 2-3 d后分瓶扩增, 取指数生长期的细胞, 以3×105/孔传代于六孔培养板长至70%融合度时, 细胞饥饿过夜, 每孔加入不同药物浓度(100、400、1000 μmol/L)和pH值(7.4、4.0)的DMEM培养, 对照组分别加入相同体积的培养基和溶酶(无水乙醇和DMSO, DCA, GC用无水乙醇溶解, CA用DMSO溶解)培养, 分别在1、2、4、8、12、24 h末收取细胞. 加入TRIzol提取细胞总RNA, 逆转录cDNA, 进行实时定量PCR测定CDX2表达量, 引物序列、探针序列、PCR条件以及方法同上文所述, CDX2表达量×102/β-actin表达量作为CDX2相对定量值.
统计学处理 采用SPSS13.0医学统计软件进行统计分析, 正态分布计量资料采用t检验, 不同组CDX表达量比较采用单因素方差分析. 检验水平为α = 0.05, P<0.05为差异显著.
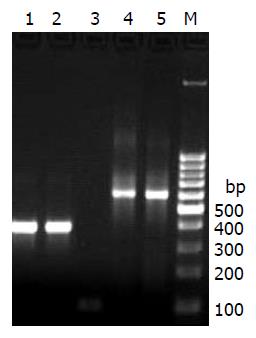
在RT-PCR中, 正常食管组织无CDX2条带, 反流性食管炎组中部分组织可见很弱的CDX2条带, BE中可见CDX2条带(图1). 正常食管组织、反流性食管炎组、Barrett's食管组所有标本中均未发现有CDX1条带, 只在阳性对照结肠组织中有CDX1表达.
正常食管组织中无CDX2 mRNA表达, CDX2 mRNA表达量在反流性食管炎组为3.9156±3.6700, BE组为9.6411±6.6823, 较正常食管组明显增加(P = 0.025; P = 0.006), 而2组间比较无显著性差异(P = 0.133). CDX1 mRNA表达量在BE组、反流性食管炎组、正常食管黏膜组织中均未测出, 仅在阳性对照结肠组织中有表达, 与RT-PCR结果一致.
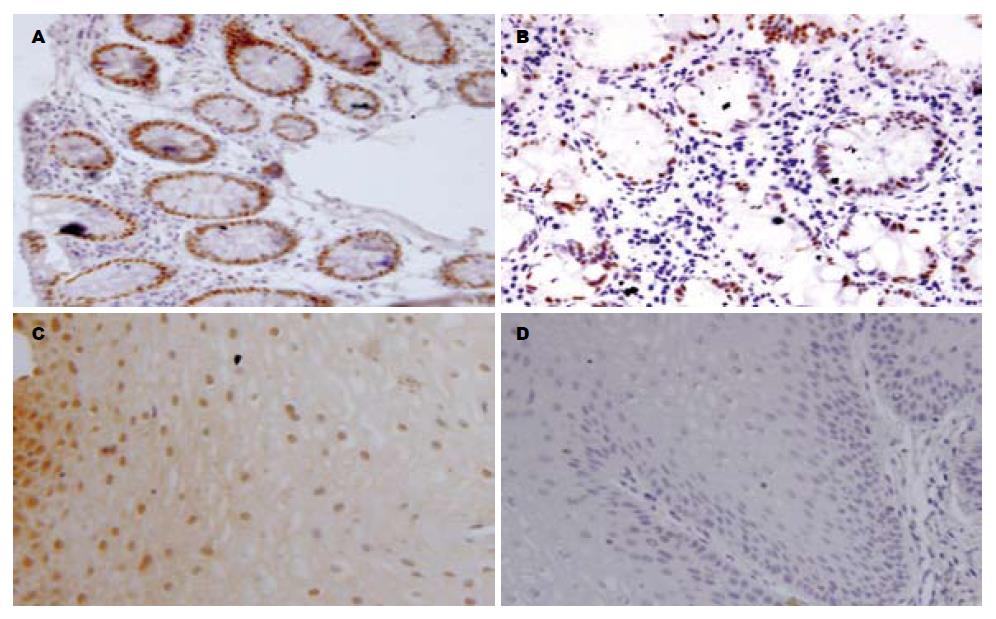
正常的结肠组织中CDX2表现为细胞核棕黄色强阳性的染色(图2A). 正常食管鳞状上皮中未见CDX2阳性免疫组化表现(图2D), BE黏膜中可以观察到肠化生的上皮细胞核呈棕黄色颗粒的阳性表现(图2B), 反流性食管炎黏膜组织显示胞质棕黄色染色的假阳性表现(图2C).
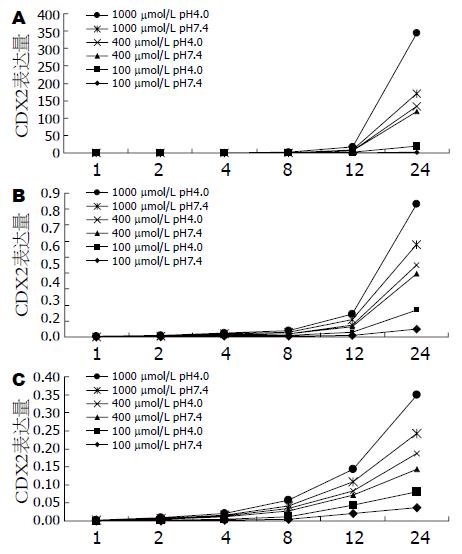
对照组、单独酸刺激组实时定量PCR未检测到CDX2 mRNA的表达, 将Eca-109置于pH 4.0 DMEM培养基中生长, 亦未发现CDX2的表达. 在3种胆酸不同浓度和pH值条件下生长的Eca-109, pH 4.0与pH 7.4相比CDX2 mRNA表达量较高; 相同浓度和pH条件下, Eca-109 CDX2 mRNA表达量在3种胆酸作用下均随着刺激时间的延长呈现升高趋势(图3). 与胆酸处理1 h相比, 处理24 h Eca-109 CDX2 mRNA表达量在不同浓度均有显著升高(表1), 其中DCA对CDX2 mRNA表达量影响最明显, 升高趋势最为显著; 胆酸处理24 h, DCA 1000 μmol/L pH 4.0 Eca-109 CDX2 mRNA表达量是CA 1000 μmol/L pH 4.0 CDX2 mRNA表达量的1629.2倍(表2), 是GC 1000 μmol/L pH 4.0 CDX2 mRNA表达量的689.6倍.
| 不同条件 | 不同胆酸 | ||
| DCA | GC | CA | |
| 100μmol/L | |||
| pH 7.4 | 7697 | 111 | 244 |
| pH 4.0 | 18814 | 130 | 267 |
| 400μmol/L | |||
| pH 7.4 | 21185 | 243 | 166 |
| pH 4.0 | 41458 | 390 | 151 |
| 1000μmol/L | |||
| pH 7.4 | 109409 | 433 | 1281 |
| pH 4.0 | 184139 | 399 | 149 |
| 不同处理 | DCA处理24 h/GC处理24 h | DCA处理24 h/CA处理24 h |
| 100 μmol/L | ||
| pH 7.4 | 59.7 | 7.91 |
| pH 4.0 | 237.2 | 313.0 |
| 400 μmol/L | ||
| pH 7.4 | 142.0 | 390.7 |
| pH 4.0 | 296.1 | 689.8 |
| 1000 μmol/L | ||
| pH 7.4 | 442.6 | 1562.9 |
| pH 4.0 | 689.8 | 1629.2 |
BE是GERD慢性并发症, 反流性食管炎患者中大约20%-25%会伴BE[9], 其发病机制目前仍然不清楚. BE的病理特征为肠上皮化生, 所以在肠分化过程中起重要作用的转录因子很可能在BE发生过程中也发挥重要的作用. 很多在肠道上皮表达基因产物(ALP、SI、HD和MUC2)在肠上皮化生中都有表达. 而CDX1和CDX2作为转录因子, 在肠上皮早期分化和维持肠上皮细胞表达中有重要的作用[10-11,17]. 国外研究[12-16]推测CDX蛋白通过与不同肠源性基因启动子结合激活转录过程, 从而启动其表达. 在异位肠化相关的研究中发现胃腺癌中CDX2有过表达[2], CDX2在胃黏膜表达可诱导转基因小鼠胃黏膜肠化生[3]. 在本研究中BE组、反流性食管炎组与正常食管组比较CDX2表达量均有显著性差异, 而反流性食管炎组和BE组间并没有显著性差异, 这提示CDX2在BE病理表现出现之前已经有表达, 即在反流性食管炎阶段就有表达, 是肠化的早期改变. CDX2的表达具体通过哪些途径促进反流性食管炎向BE转化有待于进一步的研究证实.
本实验在BE黏膜和反流性食管炎黏膜中均未发现CDX1 mRNA的表达. CDX2与CDX1同属CDX家族, 虽然二者在结构上具有高度的同源性, 但CDX2与CDX1的分布及功能有许多不同之处, 作为核转录因子, CDX1的产物主要负责肠道上皮细胞的增殖, 而CDX2的产物则负责调控肠型上皮细胞的分化. 而异位肠化过程中CDX1的作用仍不清楚. 以往的研究也发现肠上皮化生过程中, 在没有肠道上皮基因标志物表达之前, 炎症的食管上皮就已经有CDX2的表达, 而没有CDX1的表达[18], CDX2的表达要早于CDX1、SI、HD、ALP的表达[19].
免疫组织化学染色中BE组织普遍显示CDX2蛋白核棕色颗粒着色的阳性表现, 而反流性食管炎部分组织中可以观察到假阳性表现, 正常食管组织中呈现阴性表现. 以往的研究证实在从GERD向BE进展的过程中, CDX2蛋白的定位有可能是从细胞质向细胞核不断转移的过程[18], BE和食管炎黏膜中有CDX2同源蛋白的异位表达, 也显示CDX2的表达是引起BE的重要事件. 本研究与既往文献一致, 支持CDX2表达是BE发生的始发事件.
BE与GERD关系密切, 在多种反流物质中, 胆酸被认为是较严重的损伤物质[20], 动物实验已证实胆汁反流有明显的致癌作用[21], 可以使大鼠食管鳞状上皮黏膜发生肠上皮化生并且高表达CDX2[22], 临床研究中发现BE食管患者食管中有更高浓度的胆酸[23,24], 胆酸在BE、食管腺癌发生过程中有重要作用, 目前其作用途径还不清楚. 本研究发现胆酸可以诱导人食管癌细胞株Eca-109表达CDX2, 其中DCA对于CDX2的表达上调作用最明显, CDX2最大的表达量出现在含1000 μmol/L DCA DMEM(pH 4.0)刺激24 h末, CA与GC对CDX2表达均有上调作用, 其中CA对其影响较小, CDX2表达量对3种胆酸均呈现出时间-剂量的依赖趋势, 国外亦有研究报道[25]胆酸可以诱导多种人食管细胞株(Het-1A、SEG-1、HKESC-1、HKESC-2)CDX2表达, 本研究结果支持胆酸在BE发生中有重要作用. 在抑酸环境下, 结合性胆汁酸的反流可能通过影响细胞的增殖而容易使BE发生非典型增生[26], 而且伴有严重并发症(狭窄、非典型增生)的患者的反流物中有更高浓度伤害性更大的次级胆汁酸, 如DCA[27]. 现有的研究推测胆汁酸通过激活参与涉及PKC[28]、c-Myc[29]、COX-2[30]、NF-kappaB[31]细胞信号通路, 引起多种基因的活化. 另有研究支持胆酸可以引起体内DNA加合物增多, 逃避DNA自身修复导致基因突变[32-33], 同时混合性胆汁酸可以引起染色体损害[34]和单链断裂[35-37], 可能的机制为胆酸引起细胞中活性氧簇(reactive oxygen species, ROS)的释放[38-40], 从而使DNA发生氧化损伤. Avissar et al[41]推测胆酸激活上皮生长因子受体(epidermal growth factor receptor, EGFR)激活细胞信号途径从而诱导CDX2的表达. 另外, 本研究发现单独酸刺激不能诱导CDX2的表达, 酸和胆酸协同与单独胆酸刺激相比, 可以使CDX2表达水平升高更为明显, 这也就支持酸不是食管鳞状上皮发生柱状上皮化生(BE上皮发生)的必要因素, 与临床上单独酸反流患者几乎没有BE发生相一致, 胆酸在BE发病中的作用更为重要. 通过本研究提示胆酸可能是通过调节CDX2的表达水平而影响BE的发生, 但通过什么途径影响CDX2的表达仍需要进一步的研究.
本研究显示在BE和反流性食管炎中CDX2表达上调, 说明CDX2表达是BE发生过程中的重要起始事件. 胆酸尤其是脱氧胆酸在体外可以刺激CDX2的表达, 在BE发生过程中发挥重要作用.
近年来食管腺癌及其癌前病变Barrett's食管(BE)的发病率逐年上升, CDX2异位表达可诱导肠上皮化生, 其在食管黏膜中异位表达与Barrett's食管发生关系密切. 与不伴有BE的胃食管反流病患者相比, BE患者的食管中有更高浓度的胆酸, 其对BE的发生有重要作用.
张国梁, 主任医师, 天津市第一中心医院消化内科.
Barrett's食管的发病机制尚未完全清楚, 以往研究发现CDX2、胆汁酸在Barrett's食管发生中起到重要的作用, 但CDX2 RNA在Barrett's食管和反流性食管炎表达差异以及胆汁酸影响Barrett's食管的机制目前的研究比较少.
Akashi et al 2003年首次用RT-PCR方法发现CDX2在Barrett's食管和食管炎黏膜中均有表达, 推测CDX2表达是Barrett's食管发生的重要起始事件, 同时也发现在Barrett's食管中有CDX2 mRNA和蛋白的表达. 体外和动物实验证实胆汁酸对Barrett's食管、食管腺癌的发病有重要的作用, 张茹 et al 2005年的研究证实脱氧胆酸可以诱导正常人食管黏膜上皮细胞凋亡, 并且呈现浓度时间的正相关变化.
本研究用免疫组织化学和实时定量PCR的方法检测BE、反流性食管炎食管标本中CDX表达, 并检测胆酸对人食管癌细胞株Eca-109的CDX2 mRNA表达水平的变化, 探讨CDX在BE发生过程中的作用, 以及胆汁酸对CDX表达的影响.
CDX2基因异常表达在食管黏膜肠化生过程中可能具有较重要作用, CDX2基因的表达可能是Barrett's食管发生过程的早期事件.
本课题设计合理, 试验严谨, 结果可信, 结论对临床有重大的指导意义.
编辑: 李军亮 电编: 何基才
| 1. | Kim HS, Lee JS, Freund JN, Min KW, Lee JS, Kim W, Juhng SW, Park CS. CDX-2 homeobox gene expression in human gastric carcinoma and precursor lesions. J Gastroenterol Hepatol. 2006;21:438-442. [PubMed] [DOI] |
| 2. | Ko S, Chu KM, Luk JM, Wong BW, Yuen ST, Leung SY, Wong J. CDX2 co-localizes with liver-intestine cadherin in intestinal metaplasia and adenocarcinoma of the stomach. J Pathol. 2005;205:615-622. [PubMed] [DOI] |
| 3. | Silberg DG, Sullivan J, Kang E, Swain GP, Moffett J, Sund NJ, Sackett SD, Kaestner KH. Cdx2 ectopic expression induces gastric intestinal metaplasia in transgenic mice. Gastroenterology. 2002;122:689-696. [PubMed] [DOI] |
| 4. | Morgan C, Alazawi W, Sirieix P, Freeman T, Coleman N, Fitzgerald R. In vitro acid exposure has a differential effect on apoptotic and proliferative pathways in a Barrett's adenocarcinoma cell line. Am J Gastroenterol. 2004;99:218-224. [PubMed] [DOI] |
| 5. | Blot WJ, Devesa SS, Fraumeni JF Jr. Continuing climb in rates of esophageal adenocarcinoma: an update. JAMA. 1993;270:1320. [PubMed] [DOI] |
| 6. | Hamoui N, Peters JH, Schneider S, Uchida K, Yang D, Vallböhmer D, Hagen JA, DeMeester SR, DeMeester TR, Danenberg K. Increased acid exposure in patients with gastroesophageal reflux disease influences cyclooxygenase-2 gene expression in the squamous epithelium of the lower esophagus. Arch Surg. 2004;139:712-716; discussion 716-717. [PubMed] [DOI] |
| 7. | Suh E, Traber PG. An intestine-specific homeobox gene regulates proliferation and differentiation. Mol Cell Biol. 1996;16:619-625. [PubMed] |
| 9. | Sarr MG, Hamilton SR, Marrone GC, Cameron JL. Barrett's esophagus: its prevalence and association with adenocarcinoma in patients with symptoms of gastroesophageal reflux. Am J Surg. 1985;149:187-193. [PubMed] [DOI] |
| 10. | Silberg DG, Furth EE, Taylor JK, Schuck T, Chiou T, Traber PG. CDX1 protein expression in normal, metaplastic, and neoplastic human alimentary tract epithelium. Gastroenterology. 1997;113:478-486. [PubMed] [DOI] |
| 11. | Silberg DG, Swain GP, Suh ER, Traber PG. Cdx1 and cdx2 expression during intestinal development. Gastroenterology. 2000;119:961-971. [PubMed] [DOI] |
| 12. | Lorentz O, Duluc I, Arcangelis AD, Simon-Assmann P, Kedinger M, Freund JN. Key role of the Cdx2 homeobox gene in extracellular matrix-mediated intestinal cell differentiation. J Cell Biol. 1997;139:1553-1565. [PubMed] [DOI] |
| 13. | Suh E, Chen L, Taylor J, Traber PG. A homeodomain protein related to caudal regulates intestine-specific gene transcription. Mol Cell Biol. 1994;14:7340-7351. [PubMed] |
| 14. | Lambert M, Colnot S, Suh E, L'Horset F, Blin C, Calliot ME, Raymondjean M, Thomasset M, Traber PG, Perret C. cis-Acting elements and transcription factors involved in the intestinal specific expression of the rat calbindin-D9K gene: binding of the intestine-specific transcription factor Cdx-2 to the TATA box. Eur J Biochem. 1996;236:778-788. [PubMed] [DOI] |
| 15. | Yamamoto H, Miyamoto K, Li B, Taketani Y, Kitano M, Inoue Y, Morita K, Pike JW, Takeda E. The caudal-related homeodomain protein Cdx-2 regulates vitamin D receptor gene expression in the small intestine. J Bone Miner Res. 1999;14:240-247. [PubMed] [DOI] |
| 16. | Drummond FJ, Sowden J, Morrison K, Edwards YH. Colon carbonic anhydrase 1: transactivation of gene expression by the homeodomain protein Cdx2. FEBS Lett. 1998;423:218-222. [PubMed] [DOI] |
| 17. | Wong NA, Wilding J, Bartlett S, Liu Y, Warren BF, Piris J, Maynard N, Marshall R, Bodmer WF. CDX1 is an important molecular mediator of Barrett's metaplasia. Proc Natl Acad Sci USA. 2005;102:7565-7570. [PubMed] [DOI] |
| 18. | Eda A, Osawa H, Satoh K, Yanaka I, Kihira K, Ishino Y, Mutoh H, Sugano K. Aberrant expression of CDX2 in Barrett's epithelium and inflammatory esophageal mucosa. J Gastroenterol. 2003;38:14-22. [PubMed] [DOI] |
| 19. | Eda A, Osawa H, Yanaka I, Satoh K, Mutoh H, Kihira K, Sugano K. Expression of homeobox gene CDX2 precedes that of CDX1 during the progression of intestinal metaplasia. J Gastroenterol. 2002;37:94-100. [PubMed] [DOI] |
| 20. | Aries V, Crowther JS, Drasar BS, Hill MJ, Williams RE. Bacteria and the aetiology of cancer of the large bowel. Gut. 1969;10:334-335. [PubMed] [DOI] |
| 21. | Werner B, de Heer K, Mitschke H. Cholecystectomy and carcinoma of the colon. An experimental study. Z Krebsforsch Klin Onkol Cancer Res Clin Oncol. 1977;88:223-230. [PubMed] [DOI] |
| 22. | Kazumori H, Ishihara S, Rumi MA, Kadowaki Y, Kinoshita Y. Bile acids directly augment caudal related homeobox gene Cdx2 expression in oesophageal keratinocytes in Barrett's epithelium. Gut. 2006;55:16-25. [PubMed] [DOI] |
| 23. | Stein HJ, Kauer WK, Feussner H, Siewert JR. Bile reflux in benign and malignant Barrett's esophagus: effect of medical acid suppression and nissen fundoplication. J Gastrointest Surg. 1998;2:333-341. [PubMed] [DOI] |
| 25. | Hu Y, Williams VA, Gellersen O, Jones C, Watson TJ, Peters JH. The pathogenesis of Barrett's esophagus: secondary bile acids upregulate intestinal differentiation factor CDX2 expression in esophageal cells. J Gastrointest Surg. 2007;11:827-834. [PubMed] [DOI] |
| 26. | Sital RR, Kusters JG, De Rooij FW, Kuipers EJ, Siersema PD. Bile acids and Barrett's oesophagus: a sine qua non or coincidence? Scand J Gastroenterol Suppl. 2006;11-17. [PubMed] [DOI] |
| 27. | Nehra D, Howell P, Williams CP, Pye JK, Beynon J. Toxic bile acids in gastro-oesophageal reflux disease: influence of gastric acidity. Gut. 1999;44:598-602. [PubMed] |
| 28. | LaRue JM, Stratagoules ED, Martinez JD. Deoxycholic acid-induced apoptosis is switched to necrosis by bcl-2 and calphostin C. Cancer Lett. 2000;152:107-113. [PubMed] [DOI] |
| 29. | Tselepis C, Morris CD, Wakelin D, Hardy R, Perry I, Luong QT, Harper E, Harrison R, Attwood SE, Jankowski JA. Upregulation of the oncogene c-myc in Barrett's adenocarcinoma: induction of c-myc by acidified bile acid in vitro. Gut. 2003;52:174-180. [PubMed] [DOI] |
| 30. | Zhang F, Subbaramaiah K, Altorki N, Dannenberg AJ. Dihydroxy bile acids activate the transcription of cyclooxygenase-2. J Biol Chem. 1998;273:2424-2428. [PubMed] [DOI] |
| 31. | Jenkins GJ, Harries K, Doak SH, Wilmes A, Griffiths AP, Baxter JN, Parry JM. The bile acid deoxycholic acid (DCA) at neutral pH activates NF-kappaB and induces IL-8 expression in oesophageal cells in vitro. Carcinogenesis. 2004;25:317-323. [PubMed] [DOI] |
| 32. | Scates DK, Venitt S, Phillips RK, Spigelman AD. High pH reduces DNA damage caused by bile from patients with familial adenomatous polyposis: antacids may attenuate duodenal polyposis. Gut. 1995;36:918-921. [PubMed] [DOI] |
| 33. | Scates DK, Spigelman AD, Phillips RK, Venitt S. Differences in the levels and pattern of DNA-adduct labelling in human cell lines MCL-5 and CCRF, proficient or deficient in carcinogen-metabolism, treated in vitro with bile from familial adenomatous polyposis patients and from unaffected controls. Carcinogenesis. 1996;17:707-713. [PubMed] [DOI] |
| 34. | Fimognari C, Nüsse M, Cesari R, Cantelli-Forti G, Hrelia P. Micronuclei induction, cell cycle delay and apoptosis as markers of cellular stress caused by ursodeoxycholic acid in human lymphocytes. Mutat Res. 2001;495:1-9. [PubMed] |
| 35. | Kandell RL, Bernstein C. Bile salt/acid induction of DNA damage in bacterial and mammalian cells: implications for colon cancer. Nutr Cancer. 1991;16:227-238. [PubMed] |
| 36. | Booth LA, Gilmore IT, Bilton RF. Secondary bile acid induced DNA damage in HT29 cells: are free radicals involved? Free Radic Res. 1997;26:135-144. [PubMed] [DOI] |
| 37. | Jolly AJ, Wild CP, Hardie LJ. Acid and bile salts induce DNA damage in human oesophageal cell lines. Mutagenesis. 2004;19:319-324. [PubMed] [DOI] |
| 38. | Patel T, Gores GJ. Inhibition of bile-salt-induced hepatocyte apoptosis by the antioxidant lazaroid U83836E. Toxicol Appl Pharmacol. 1997;142:116-122. [PubMed] [DOI] |
| 39. | Fang Y, Han SI, Mitchell C, Gupta S, Studer E, Grant S, Hylemon PB, Dent P. Bile acids induce mitochondrial ROS, which promote activation of receptor tyrosine kinases and signaling pathways in rat hepatocytes. Hepatology. 2004;40:961-971. [PubMed] |
| 40. | Jenkins GJ, D'Souza FR, Suzen SH, Eltahir ZS, James SA, Parry JM, Griffiths PA, Baxter JN. Deoxycholic acid at neutral and acid pH, is genotoxic to oesophageal cells through the induction of ROS: The potential role of anti-oxidants in Barrett's oesophagus. Carcinogenesis. 2007;28:136-142. [PubMed] [DOI] |
| 41. | Avissar NE, Toia L, Hu Y, Watson TJ, Jones C, Raymond DP, Matousek A, Peters JH. Bile acid alone, or in combination with acid, induces CDX2 expression through activation of the epidermal growth factor receptor (EGFR). J Gastrointest Surg. 2009;13:212-222. [PubMed] [DOI] |