修回日期: 2008-06-05
接受日期: 2008-06-12
在线出版日期: 2008-07-18
目的: 检测人垂体瘤转化基因1(hPTTG1)在结直肠癌中的表达, 分析其与临床病理参数之间的关系, 为阐明hPTTG1在结直肠癌诊断和转移复发中的临床价值提供实验依据.
方法: 收集我院2004-01/2006-09结直肠癌及对应癌旁组织的手术标本60例. 采用免疫组织化学和Western blotting检测结直肠癌组织与对应癌旁组织hPTTG1蛋白的表达, 并探讨其与临床病理指标的关系.
结果: 60例结直肠癌组织有56例表达hPTTG1蛋白, 阳性率为93.3%, 而癌旁组织hPTTG1仅8例表达, 且均为弱阳性, 阳性率为13.3%(c2 = 77.13, P<0.001). hPTTG1表达与血清CEA水平具有显著相关, 血清CEA大于5 mg/L较小于5 mg/L显著增高(c2 = 30.886, P<0.001). hPTTG1在Dukes C、D期显著高于Dukes A、B期(c2 = 9.87, P<0.001). 伴有淋巴转移、肝转移或其他器官转移者较无转移者显著增高(c2 = 9.87, P<0.001). hPTTG1与患者的性别、年龄、肿瘤直径大小和病理分型无关.
结论: hPTTG1在结直肠癌中高表达, 与结肠癌的疾病进展密切相关, 检测hPTTG1有助于患者预后的判断.
引文著录: 吴斌文, 马东, 李友佳, 李东风, 邓罡, 曾志刚, 张凯军, 张瑛华, 耿庆山. hPTTG1在结直肠癌中的表达及其临床意义. 世界华人消化杂志 2008; 16(20): 2248-2252
Revised: June 5, 2008
Accepted: June 12, 2008
Published online: July 18, 2008
AIM: To investigated the expression of human pituitary tumor transforming gene 1 (hPTTG1) protein in colorectal cancerous tissues and to analyze its relationship with clinicopathological parameters so as to gain more experimental evidence for hPTTG1's clinical value in colorectal cancer diagnosis and relapse.
METHODS: Sixty colorectal cancer samples and their corresponding noncancerous tissues were examined for hPTTG1 protein expression using immunohistochemical staining and Western blotting analysis. Subsequently, we also studied the relationship between seven clinicopathological parameters and hPTTG1 protein expression.
RESULTS: Of 60 colorectal tissue samples, 50 samples of hPTTG1 protein expression were positive (93.3%), but only 8 corresponding noncancerous tissues were positive and all weakly positive (13.3%) (c2 = 77.13, P < 0.001). There was a significant correlation between hPTTG1 mRNA expression and serum CEA level, and CEA ≥ 5 mg/L was significantly higher than CEA < 5 mg/L (c2 = 30.886, P < 0.001); hPTTG1 gene was expressed significantly higher in Dukes C, D stages than in Dukes A, B stages (c2 = 9.87, P < 0.001), and significantly higher in colorectal cancer with the lymph node invasion, liver or other organs metastasis than no invasion (c2 = 9.87, P < 0.001). The hPTTG1 expression was not correlated with age, sex, tumor size or histologic types.
CONCLUSION: The hPTTG1 is overexpressed in and closely correlated with the progress of colorectal cancer, therefore hPTTG1 expression may be helpful for the judgement of the prognosis for colorectal cancer patients.
- Citation: Wu BW, Ma D, Li YJ, Li DF, Deng G, Zheng ZG, Zhang KJ, Zhang YH, Geng QS. Expression of human pituitary tumor transforming gene 1 in colorectal cancer and its clinical significance. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2248-2252
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2248.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2248
胃结肠癌是常见的恶性肿瘤之一, 手术治疗可以改善患者的预后, 但许多患者术后出现复发或转移. 判断患者是否有复发或转移的倾向, 及时选择术后化疗, 对于Dukes A、B期的患者尤为重要. 寻找结直肠癌复发转移和预后判断的分子标志有现实的临床意义. 垂体瘤转化基因(pituitary-tumour transforming gene, PTTG)是新近发现的一种癌基因, 是17种与肿瘤转移相关基因之一[1]. 人类肿瘤中主要表达hPTTG1(human pituitary tumor transforming gene 1). 在成人大多数正常组织hPTTG1表达较弱, 甚至检测不到, 而在肿瘤组织中高表达, 尤其在垂体瘤、卵巢癌、肝癌、肾癌等内分泌器官发生的癌症中高表达[2]. hPTTG1可导致染色体不稳定性和非整倍体的形成, 导致肿瘤的发生[2]; 还可调节p53基因, 导致下游癌基因的活化[3]. 在结肠癌中相关研究较少. 我们采用免疫组织化学和Western blotting, 检测结肠癌中hPTTG1表达, 同时分析hPTTG1表达与病理类型、淋巴结或肝肺等转移、CEA水平以及Dukes分期等临床病理参数的关系, 探讨hPTTG1与结直肠癌生物学行为的关系.
收集我院2004-01/2006-09结直肠癌及对应癌旁5 cm组织的手术标本, 分别石蜡包埋和-70℃保存备用. 所有病例均有完整临床资料并随访. 男28例, 女32例, 年龄31-86岁, 平均61岁. 左半结肠癌15例, 右半结肠癌20例, 直肠癌25例, 高分化腺癌7例, 中分化腺癌47例, 低分化腺癌6例. Dukes分期: A期2例, B期27例, C期21例, D期8例. 所有病例均经病理确诊. hPTTG1兔抗人多克隆抗体为Zymed Laboratory产品; SP试剂盒购自北京中山生物公司.
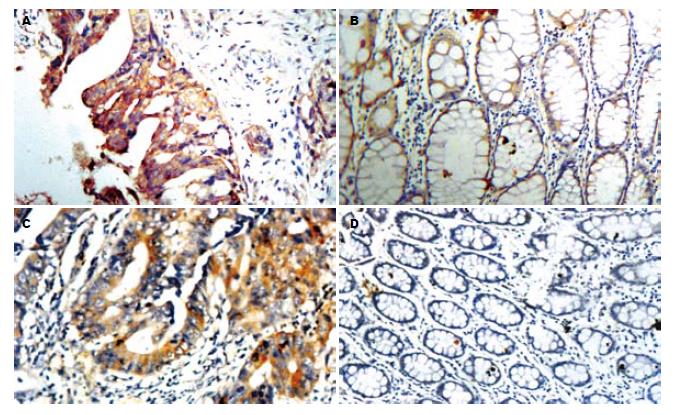
1.2.1 免疫组织化学染色: 组织切片常规脱腊至水, 置枸橼酸盐抗原修复液中用微波炉抗原修复10 min, 自然冷却至室温; 30 mL/L H2O2封闭20 min, 20 mL/L羊血清37℃封闭30 min, 分别滴加抗hPTTG1兔抗人多克隆抗体(1:50), 4℃冰箱过夜, PBS缓冲液冲洗, 滴加生物素标志二抗, 37℃孵育30 min, PBS缓冲液冲洗, DAB显色, 蒸馏水冲洗, 苏木素复染, 封片. 用PBS代替一抗作染色的阴性对照. hPTTG1以肿瘤细胞胞质出现棕黄色颗粒为阳性细胞. 结果判断: 光学显微镜下观察, 阳性细胞胞膜、胞质或者胞核出现棕黄色颗粒. 在低倍镜(40×)下观察hPTTG1表达较强的区域, 高倍镜(200×)观察3个视野, 计数阳性细胞所占的百分比. 阳性细胞超过肿瘤细胞数的10%定义为阳性, 否则为阴性. 阳性细胞率<25%者为(+); 阳性细胞率占25%-50%者为(++); 阳性细胞率>50%者为(+++). 结合临床资料, 统计60例大肠癌患者癌组织hPTTG1表达与临床病理类型、肿瘤大小、分化程度、Duke分期和淋巴结转移之间的关系.
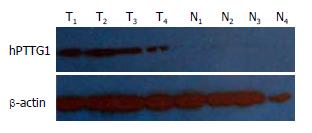
1.2.2 Western blotting分析: 取适量(250-500 mg)-70℃保存的结肠癌组织, 加1 mL含蛋白酶抑制剂的总蛋白抽提试剂, 匀浆后抽提总蛋白. 按BCA蛋白质定量试剂盒操作说明操作, 测定样品浓度. 不同样品取等量蛋白变性聚丙烯酰胺不连续凝胶电泳(SDS-PAGE). 按Bio-Rad蛋白转移装置说明组装滤纸凝胶纤维素夹层, 30 mA恒流条件下, 蛋白质转移到PVDF膜. 50 g/L脱脂奶粉溶液中室温孵育1 h, 立即加入稀释好的一抗, 4℃缓慢摇动孵育过夜, 洗涤液洗涤5-10 min, 共洗涤3次. 辣根过氧化物酶(HRP)标志的二抗, 4℃缓慢摇动孵育1 h. ECL显色, 适时终止反应. ECL Western blotting analysis system(Amersham Biosciences, Piscataway, NJ, USA)检测并成像.
统计学处理 结直肠癌临床病理参数与hPTTG1蛋白表达率之间的比较采用χ2检验. 实验数据采用SPSS13.0统计分析软件分析, P<0.05有统计学意义.
免疫组织化学结果显示, 在结直肠癌中hPTTG1蛋白呈现高表达, 癌旁组织中无表达或低表达(图1). 60例结直肠癌患者癌组织中的hPTTG1阳性率为93.3%(56/60), 而癌旁组织hPTTG1仅8例表达, 且均为弱阳性, 阳性率为13.3%, 表达率有极显著差异(χ2 = 77.13, P<0.001). 56例结直肠癌患者hPTTG1阳性表达患者中, (+)表达27例, (++)表达21例, (+++)表达8例. 将癌组织hPTTG1低表达组(-, +)与高表达组(++, +++)比较, 发现Dukes C、D期较Dukes A、B期显著增高, 差异有极显著性(χ2 = 9.87, P<0.001), 伴淋巴结或肝肺等转移者较无转移者显著增高, 差异有极显著性(χ2 = 9.87, P<0.001), 血清CEA大于5 mg/L较小于5 mg/L显著增高(χ2 = 30.886, P<0.001). 但是hPTTG1表达强度与患者的性别、年龄以及肿瘤直径的大小和分化程度无相关性(P>0.05, 表1).
| 临床病理参数 | n | hPTTG1表达 | χ2 | P | |||||
| - | + | ++ | +++ | ||||||
| 年龄(岁) | |||||||||
| <65 | 31 | 1 | 17 | 9 | 4 | 1.050 | 0.305 | ||
| ≥65 | 29 | 3 | 10 | 12 | 4 | ||||
| 性别 | |||||||||
| 男 | 28 | 1 | 14 | 8 | 5 | 0.076 | 0.782 | ||
| 女 | 32 | 3 | 13 | 13 | 3 | ||||
| CEA(mg/L) | |||||||||
| <5 | 37 | 4 | 26 | 8 | 0 | 30.886 | 0.0001 | ||
| >5 | 23 | 0 | 1 | 13 | 8 | ||||
| Dukes分期 | |||||||||
| A | 2 | 2 | 0 | 0 | 0 | 9.870 | 0.002 | ||
| B | 25 | 2 | 16 | 7 | 0 | ||||
| C | 24 | 0 | 11 | 12 | 1 | ||||
| D | 9 | 0 | 0 | 2 | 7 | ||||
| 肿瘤大小(cm) | |||||||||
| <3.5 | 16 | 1 | 9 | 5 | 1 | 1.025 | 0.311 | ||
| ≥3.5 | 44 | 3 | 18 | 16 | 7 | ||||
| 病理分型 | |||||||||
| 高分化 | 7 | 1 | 5 | 0 | 1 | 4.197 | 0.120 | ||
| 中分化 | 47 | 2 | 21 | 18 | 6 | ||||
| 低分化 | 6 | 1 | 1 | 3 | 1 | ||||
| 肿瘤转移 | |||||||||
| 无转移 | 27 | 4 | 16 | 7 | 0 | 9.870 | 0.002 | ||
| 淋巴结转移 | 31 | 0 | 11 | 12 | 6 | ||||
| 肝转移 | 6 | 0 | 0 | 4 | 2 | ||||
| 其他部位转移 | 3 | 0 | 0 | 1 | 2 | ||||
hPTTG1是新近发现的一种与多种肿瘤转移相关的癌基因. 人类PTTG至少有三种亚型, 肿瘤中主要表达hPTTG1, 在成人大多数正常组织hPTTG1表达较弱, 甚至检测不到, 而在肿瘤组织中高表达. hPTTG1表达与肝癌、神经胶质瘤预后有关, 有可能成为预后判断的分子标志[4-6]. 结直肠癌有关hPTTG1研究较少. Heaney et al利用RT-PCR检测到PTTG mRNA在48例结肠癌和20例结肠息肉中的19例均比正常结肠黏膜高表达, 且两者中PTTG mRNA的含量平均都是正常结肠黏膜的2.2倍, 在有周围淋巴结转移的结肠癌中其表达率较无转移的结肠癌高, Ducks C、D期较A、B期结肠癌的PTTG mRNA表达高[3].
近年研究发现, Wnt-β-catenin信号通路与结肠癌的发生、发展以及侵润转移密切相关, 约80%的结直肠癌发生APC基因突变, Wnt-β-catenin信号通路与结直肠癌密切相关[7]. Hlubek et al发现hPTTG亦为β-catenin的靶基因, β-catenin/TCF 信号途径失调导致hPTTG1的过度表达, 与食管癌[8]、结肠癌[9]的发生、发展有关. 本研究采用免疫组织化学和Western blotting检测了hPTTG1在结直肠癌中的表达. 结果显示, 60例结直肠癌组织中有56例阳性表达, 阳性率为93.3%; 而癌旁组织hPTTG1仅8例表达, 且均为弱阳性, 阳性率为13.3%. 其中有周围淋巴结转移或肝脏等器官转移者较无转移者高; Ducks C、D期较A、B期结肠癌表达高. 表明hPTTG1在结直肠癌中不仅高水平表达, 而且与结直肠癌的分期、转移有关. 提示hPTTG1高表达的结直肠癌发生转移的可能性高. 相反, hPTTG1与患者的性别、年龄以及肿瘤直径的大小和分化程度无关.
血清癌胚抗原(CEA)是消化系统恶性肿瘤诊断的可靠指标之一, 尤其对结肠癌意义最大. 张青云 et al[10]分别采用时间分辨荧光免疫法与电化学发光法检测结直肠肿瘤血清CEA水平, 灵敏度分别为60.0%、66.7%, 特异性98.3%、100%, 准确性85.6%、88.9%, 阳性预测值94.7%、95.2%及阴性预测值83.1%、85.7%. 而且CEA对结直肠癌的转移、复发和预后评估具有重要意义. 血清CEA mRNA阳性可预测是否发生肝转移或局部复发, 准确性达80%, 肝转移敏感性95%, 5年存活特异性84%[11]. CEA是结直肠癌的肝转移和早期复发的良好预测指标[12]. 特别对于Dukes A期的结直肠癌, 如果CEA增高则需慎重考虑辅助化疗以防止肿瘤复发[13]. 如果术后CEA水平增高大于1 mg/L, 则预示肿瘤复发或转移的可能, 敏感性80%, 特异性86%[14]. 本研究显示, hPTTG1和CEA水平密切相关, 当CEA大于5 mg/L时, 结直肠癌hPTTG1高表达, 较CEA小于5 mg/L显著增高, 差异有极显著性. 提示hPTTG1对结直肠癌预后的评估有着良好的应用前景. 由于hPTTG1可能通过促进成纤维细胞生长因子-2(FGF-2)、血管内皮生长因子(VEGF)的表达, 参与肿瘤的新生血管形成, 导致肿瘤的复发和转移[15-16], 因此, 在癌胚抗原CEA增高之前, 检测hPTTG1有可能对肿瘤的复发和转移作出早期预测. 随着临床资料的随访, hPTTG1与结直肠癌存活率和无病生存期的关系有待进一步探讨.
总之, hPTTG1在结直肠癌中高表达, hPTTG1表达与结直肠癌的生物学特性密切相关, 与结直肠癌的恶性程度及是否转移相关, 有可能成为结直肠癌预后判断的分子标志.
结肠癌是常见的恶性肿瘤之一, 手术治疗可以改善患者的预后, 但许多患者术后出现复发或转移. 判断患者是否有复发或转移的倾向, 及时选择术后化疗, 对于Dukes A, B期的患者尤为重要. 寻找结直肠癌复发转移和预后判断的分子标志有现实的临床意义.
王晓艳, 副教授, 中南大学湘雅三医院消化内科; 孙延平, 副主任医师, 中国人民解放军第二军医大学附属长征医院普外科
hPTTG1最早发现于垂体瘤, 可导致染色体不稳定性和非整倍体的形成, 导致肿瘤的发生; 还可调节p53基因, 导致下游癌基因的活化; 促进肿瘤的新生血管形成, 参与肿瘤的转移复发. 在神经胶质瘤、食管癌和肝癌均有与预后相关的报道, 对其分子机制和临床应用价值的研究是目前研究的热点.
hPTTG1是新近发现的一种与多种肿瘤转移相关的癌基因, hPTTG1表达与肝癌、神经胶质瘤预后有关, 有可能成为预后判断的分子标志. hPTTG1可能通过促进成纤维细胞生长因子-2(FGF-2)、血管内皮生长因子(VEGF)的表达, 参与肿瘤的新生血管形成和淋巴转移, 导致肿瘤的复发和转移. 在治疗方面, 干扰 RNA沉默hPTTG1基因, 有可能成为治疗肿瘤的途径之一.
本文应用免疫组织化学和Western blotting检测hPTTG1蛋白在结直肠癌中的表达及其与临床病理参数的关系.
hPTTG1在结直肠癌中高表达, 与结直肠癌的生物学特性密切相关, 与结直肠癌的恶性程度及是否转移相关, 有可能成为结直肠癌预后判断的分子标志.
本文条理清楚, 语言流畅, 内容新颖, 具有较高的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Ramaswamy S, Ross KN, Lander ES, Golub TR. A molecular signature of metastasis in primary solid tumors. Nat Genet. 2003;33:49-54. [PubMed] [DOI] |
| 2. | Zou H, McGarry TJ, Bernal T, Kirschner MW. Identification of a vertebrate sister-chromatid separation inhibitor involved in transformation and tumorigenesis. Science. 1999;285:418-422. [PubMed] [DOI] |
| 3. | Hamid T, Kakar SS. PTTG/securin activates expression of p53 and modulates its function. Mol Cancer. 2004;3:18. [PubMed] [DOI] |
| 4. | Fujii T, Nomoto S, Koshikawa K, Yatabe Y, Teshigawara O, Mori T, Inoue S, Takeda S, Nakao A. Overexpression of pituitary tumor transforming gene 1 in HCC is associated with angiogenesis and poor prognosis. Hepatology. 2006;43:1267-1275. [PubMed] [DOI] |
| 5. | Su MC, Hsu HC, Liu YJ, Jeng YM. Overexpression of pituitary tumor-transforming gene-1 in hepatocellular carcinoma. Hepatogastroenterology. 2006;53:262-265. [PubMed] |
| 6. | Genkai N, Homma J, Sano M, Tanaka R, Yamanaka R. Increased expression of pituitary tumor-transforming gene (PTTG)-1 is correlated with poor prognosis in glioma patients. Oncol Rep. 2006;15:1569-1574. [PubMed] |
| 7. | Behrens J. The role of the Wnt signalling pathway in colorectal tumorigenesis. Biochem Soc Trans. 2005;33:672-675. [PubMed] [DOI] |
| 8. | Zhou C, Liu S, Zhou X, Xue L, Quan L, Lu N, Zhang G, Bai J, Wang Y, Liu Z. Overexpression of human pituitary tumor transforming gene (hPTTG), is regulated by beta-catenin /TCF pathway in human esophageal squamous cell carcinoma. Int J Cancer. 2005;113:891-898. [PubMed] [DOI] |
| 9. | Hlubek F, Pfeiffer S, Budczies J, Spaderna S, Jung A, Kirchner T, Brabletz T. Securin (hPTTG1) expression is regulated by beta-catenin/TCF in human colorectal carcinoma. Br J Cancer. 2006;94:1672-1677. [PubMed] |
| 11. | Kanellos I, Zacharakis E, Kanellos D, Pramateftakis MG, Tsahalis T, Altsitsiadis E, Betsis D. Prognostic significance of CEA levels and detection of CEA mRNA in draining venous blood in patients with colorectal cancer. J Surg Oncol. 2006;94:3-8. [PubMed] [DOI] |
| 12. | Liska V, Holubec L Jr, Treska V, Skalicky T, Sutnar A, Kormunda S, Pesta M, Finek J, Rousarova M, Topolcan O. Dynamics of serum levels of tumour markers and prognosis of recurrence and survival after liver surgery for colorectal liver metastases. Anticancer Res. 2007;27:2861-2864. [PubMed] |
| 13. | Uehara M, Manaka D, Baba S, Oji Y, Hirata K, Shimizu M, Noguchi M. [Prognostic study of preoperative serum levels of CEA and CA 19-9 in colorectal cancer]. Gan To Kagaku Ryoho. 2007;34:1413-1417. [PubMed] |
| 14. | Irvine T, Scott M, Clark CI. A small rise in CEA is sensitive for recurrence after surgery for colorectal cancer. Colorectal Dis. 2007;9:527-531. [PubMed] [DOI] |
| 15. | McCabe CJ, Khaira JS, Boelaert K, Heaney AP, Tannahill LA, Hussain S, Mitchell R, Olliff J, Sheppard MC, Franklyn JA. Expression of pituitary tumour transforming gene (PTTG) and fibroblast growth factor-2 (FGF-2) in human pituitary adenomas: relationships to clinical tumour behaviour. Clin Endocrinol (Oxf). 2003;58:141-150. [PubMed] [DOI] |
| 16. | Kim DS, Franklyn JA, Stratford AL, Boelaert K, Watkinson JC, Eggo MC, McCabe CJ. Pituitary tumor-transforming gene regulates multiple downstream angiogenic genes in thyroid cancer. J Clin Endocrinol Metab. 2006;91:1119-1128. [PubMed] [DOI] |