修回日期: 2008-04-01
接受日期: 2008-05-10
在线出版日期: 2008-05-18
目的: 研究配对胃癌组织及转移淋巴结组织中中PANDER基因表达, 并分析其与胃癌临床病理及预后的相关性.
方法: 用RT-PCR检测22例配对胃癌及对应切缘正常胃黏膜组织中PANDER mRNA的表达; 制备PANDER cRNA探针, 并构建胃癌组织芯片, 用原位杂交方法检测208例配对的胃癌组织及转移淋巴结中PANDER基因的表达, 分析PANDER基因表达与胃癌临床病理及预后之间的相关性.
结果: RT-PCR显示16/22例(72.7%)胃癌中PANDER基因表达下降. 原位杂交证实从正常胃黏膜至转移淋巴结, PANDER阳性率依次降低(χ2 = 81.135, P = 0.00). PANDER基因在60.9%胃癌组织中表达下降, 早期胃癌与进展期胃癌表达下降的比率无差别(χ2 = 5.362, P = 0.147). 肿瘤组织PANDER基因表达与浸润深度有关, 局限在黏膜和黏膜下层浸润者PANDER表达高于已经浸润至肌层和浆膜层者(Z = -2.52, P = 0.012); 胃癌组织中PANDER基因表达与胃癌预后无关.
结论: 胃癌组织中PANDER表达的下降是胃癌早期事件, 可能与胃癌的发生、发展相关.
引文著录: 黄海力, 吴本俨, 杨少波, 邵勇, 尤纬缔, 王卫华, 王孟薇. PANDER基因在胃癌中的表达下调. 世界华人消化杂志 2008; 16(14): 1513-1518
Revised: April 1, 2008
Accepted: May 10, 2008
Published online: May 18, 2008
AIM: To investigate the expression of PANDER gene in paired gastric cancer tissues and metastatic lymphatic tissues, and to evaluate its relationship with the clinicopathologic characteristics and disease prognosis.
METHODS: Reverse transcription-polymerase chain reaction (RT-PCR) was used to examine the expression of PANDER mRNA in 22 fresh surgical samples of primary gastric cancer tissues and their paired surrounding normal gastric mucosa. A gastric cancer tissue microarray containing 1020 duplicate matched normal mucosa, malignant tissues and metastatic lymphatic tissues from 208 gastric cancer patients was constructed. In situ hybridization analysis was performed on the tissue microarray and the correlation between PANDER mRNA expression and clinicopathologic factors was analyzed.
RESULTS: RT-PCR showed that the expression of PANDER mRNA decreased in 72.7% (16/22) of gastric cancer samples. Similar results were obtained by in situ hybridization analysis (60.9%, 112/184). The expression of PANDER mRNA showed an ordinally decreasing trend in the matched normal mucosa, tumor tissues and metastatic lymphatic tissues (χ2 = 81.135, P = 0.00). There was no difference between early gastric cancer and progressive gastric cancer (χ2 = 5.362, P = 0.147). In tumor tissues, lower expression of PANDER mRNA was associated with deeper invasion (Z = -2.52, P = 0.012). There was no correlation between PANDER mRNA expression and disease prognosis.
CONCLUSION: Down-regulation of PANDER gene expression occurs at the early stage of gastric cancer, which may be involved in the genesis and development of gastric cancer.
- Citation: Huang HL, Wu BY, Yang SB, Shao Y, You WD, Wang WH, Wang MW. Down-regulation of PANDER mRNA in gastric cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(14): 1513-1518
- URL: https://www.wjgnet.com/1009-3079/full/v16/i14/1513.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i14.1513
胃胃癌的分子发病机制远未阐明, 本实验室在前期基因芯片研究胃癌差异表达谱基因中发现FAM3B基因在14/18例胃癌中表达下降[1-2].FAM3B近来改称为PANDER(pancreatic-derived factor), 该基因定位于21q22.3区, 全长1384 bp, 编码含235个氨基酸的蛋白. 2002年Zhu et al[3]用蛋白质拓扑结构近似算法结合生物信息分析克隆得到的一个细胞因子类新基因家族, 该家族有4个成员, 分别命名为FAM3A, FAM3B, FAM3C, FAM3D, 他们具有共同的4个α螺旋结构及up-up-down-down的拓扑形态. 目前, 对该分子功能的研究仍相对局限于对胰岛细胞凋亡影响与机制方面. 初步的研究提示FAM3B能诱导胰岛细胞的凋亡, 并且具有时间和浓度依赖性, 推测可能在Ⅰ型糖尿病胰岛细胞自身免疫损伤中发挥一定的作用[4-5]; 其机制主要通过激活CAPS3基因并且下调CDKN1A基因通路来实现, 该通路不同于以往传统的细胞因子诱导凋亡通路[6-7]. 目前未见有该基因与肿瘤相关的文献报道, 为获得PANDER与胃癌相关的进一步证据, 我们用RT-PCR结合原位杂交方法检测PANDER基因在配对的正常胃黏膜、胃癌组织以及转移淋巴结中的表达, 分析该基因表达与胃癌临床病理以及预后之间的相关性.
RT-PCR标本来源于本院2004-03/2004-05手术切除22例胃癌组织, 配对组织取于距离癌灶至少5 cm以上处的切缘黏膜; 标本离体后30 min内取材, 迅速置于液氮中冷冻后存放于-80℃冰箱. 构建组织芯片的208例胃癌手术患者标本均来源于中国人民解放军总医院1992/2002年胃癌手术患者; 患者均为首次发现胃癌, 术前没有经过放化疗或免疫治疗, 影像学检查均未发现有远隔脏器或淋巴结转移; 手术切除彻底, 手术标本残端及切缘均未见有残留癌细胞. 208例患者中男171例(82.2%), 女37例(17.8%); 60岁以下93例(44.7%), 60岁和以上115例(55.3%); 胃底和贲门癌58例(27.9%), 胃体癌40例(19.2%), 胃窦及幽门癌110例(52.9%); 黏膜或者黏膜下层浸润者58例, 浸润至肌层和浆膜层者150例; 有淋巴结转移者91例, 无淋巴结转移者117例. 按照UICC1997年胃癌TNM分期, 0, Ⅰ, Ⅱ, Ⅲ期例数分别为27例(13.0%), 74例(35.6%), 61例(29.3%), 46例(22.1%). 截止到2004-12, 患者平均随访时间为48 mo, 所有患者中死亡64例, 存活139例, 失访5例, 最长生存时间为153 mo. TRIzol及反转录试剂盒(SuperScriptm First-Strand Synthesis System for RT-PCR)购自Gibco公司. cRNA探针标记试剂盒(DIG SP6/T7 RNA Labeling Kit)购自Roche Molecular Biochemicals公司. TaKaRa Ex Taq购自宝生物工程公司.
1.2.1 组织芯片的构建: 每例患者肿瘤病灶和黏膜分别选择两个区域打孔, 有淋巴结转移病灶者, 附加转移灶两个区域打孔.每个组织芯的直径为1 mm, 共1020个组织芯构建于7个组织芯片蜡块上.
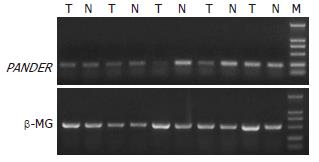
1.2.2 RT-PCR: 提取总RNA及反转录具体步骤参照TRIzol及反转录试剂盒说明书(Gibco Brl), 紫外分光光度计和凝胶电泳进行总RNA浓度、纯度以及完整性的鉴定. 每份标本取5 μg总RNA, 加1 U SuperScript Ⅲ转录为cDNA. Primer premier version 5.0软件设计引物, Oligo version 6.0软件进一步评价引物. PANDER(NM_058186)序列; 正向引物5'-TGGTGTTCGTGGTCTTCG-3, 反向引物: 5'-TGGCGTACTTGCTTCTGC-3', 理论扩增长度234 bp; β2-microglobulin(β-MG, NM_004080)作为内标, 引物序列; 正向引物: 5'-GCTATCCAGCGTACTCCAAAGA-3, 反向引物: 5'-AGAGCTACCTGTGGAGCAACCT-3, 理论扩增长度522 bp. 反应体系; Ex Taq(5 U/μL)0.125 μL, 10×Buffer 2 μL, dNTP Mixture(2.5 mmol/L each)2 μL, cDNA(from the first-strand reation)1 μL, 正向引物(10 μmol/L)1 μL, 反向引物(10 μmol/L)1 μL, 加ddH2O总量至20 μL. 反应条件; 94℃ 3 min, 94℃ 30 s, 退火30 s, 72℃ 30 s, 30循环; 72℃延伸7 min. PANDER基因退火温度为56℃, β2-MG基因退火温度为53℃. PCR产物凝胶电泳, 用BandScan软件分析各条带光密度值, 内标矫正后进行比较.
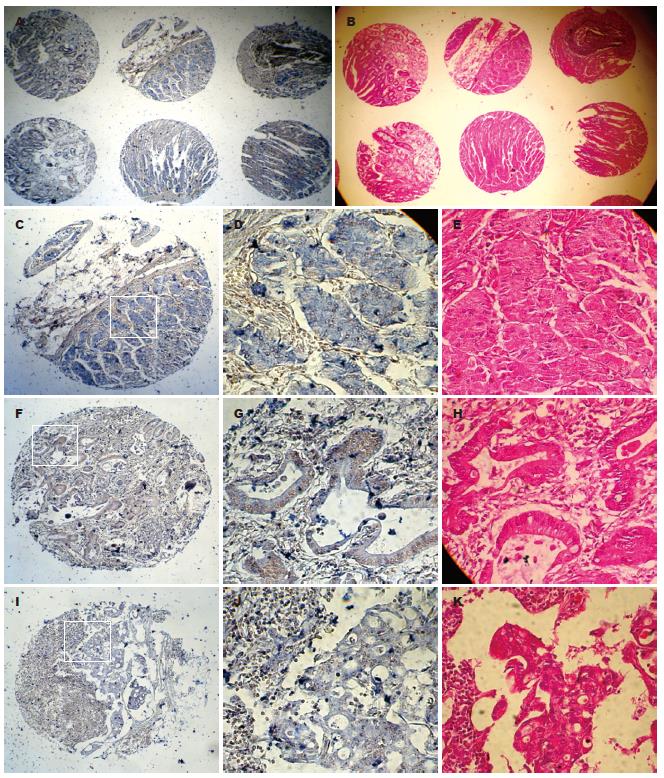
1.2.3 原位杂交检测FAM3B基因在胃癌中的表达: 采用体外转录法制备Digoxigenin标记的PANDER正义和反义cRNA探针. cRNA探针两端序列如下; 正向序列: 5'-AACTGCAGGGAGCGGCACCTGGAAGA-3', 反向序列5'-GCTCTAGACAGGGAGTCCAGTGGTCACATT-3', 探针长度为222 bp. 杂交前组织芯片切片的各项处理均按RNA要求操作. 经预杂交后, 加100 μL含200 ng地高辛标记cRNA探针的杂交液, 50℃湿盒内杂交过夜. 常规杂交后处理, 每张切片加1:500稀释的碱性磷酸酶标记的抗地高辛抗体200 μL, 室温在温盒内孵育2 h, NBT、BCIP显色过夜. 以不加探针和加正义探针杂交作为阴性对照.
1.2.4 结果判定: 镜下观察; 在BX-60 Olympus光学显微镜下观察, 用Image-Pro Plus软件分析胃腺细胞的吸光度均值, 对于部分因组织结构混乱或者有非特异染色而导致软件判断明显出现偏差的病例, 则用肉眼协助判断. 平均灰度值<0.6为阴性(-), 0.6-0.8为阳性(+), >0.8为强阳性(++).
统计学处理 SPSS12.0软件进行统计. PANDER表达在肿瘤、对应正常和转移淋巴结组织中差异的分析用配对秩和检验(Wilcoxon Signed Ranks test). 与临床病理类型之间的差异比较用两独立样本的秩和检验(Mann-Whitney U test)或者多个独立样本的秩和检验(Kruskal-Wallis H test). Kaplan-Meier法绘制生存率曲线, 生存率影响的单因素分析用Log-rank检验. P≤0.05为差异具有显著性.
胃癌组织中FAM3B阳性率为86%(19/22), 正常胃黏膜中PANDER阳性率为95%(21/22), BandScan软件分析凝胶电泳条带的光密度值并用内标进行校正后显示72.7%(16/22)的胃癌组织PANDER表达下降(图1).
总体印象; 不加探针和加正义探针杂交未显色, 加反义探针显色良好. 几乎所有正常腺体均有表达, 阳性信号主要位于固有腺体或者靠近黏膜肌层的腺体, 表层腺体着色较弱. 部分肿瘤灶和淋巴结转移灶有弱表达, 多数无表达. 阳性信号均位于细胞质. 正常腺体表达强于肿瘤灶和转移灶. 间质淋巴细胞和平滑肌细胞无表达或者仅有微弱的非特异着色(图2).
镜下判断; 去除因杂交脱片损失的病例, 可配对比较的病例为184例, PANDER在112/184例(60.9%)胃癌中表达下降(表1); 早期胃癌与进展期胃癌表达下降的比率无差别(Person χ2 test, χ2 = 5.362, P = 0.147). 按照配对等级资料进行检验, 正常胃黏膜表达高于肿瘤组织(Wilcoxon Signed Ranks test, Z = -8.625, P = 0.00), 能有效配对比较的75例有淋巴结转移的患者, 正常胃黏膜表达高于肿瘤组织, 肿瘤组织表达高于转移的淋巴结病灶(Friedman Test, χ2 = 81.135, P = 0.00
| 分类 | n | 表达升高 | 表达不变 | 表达下降 |
| 早期胃癌 | 51 | 5(9.8) | 17(33.3) | 29(56.9) |
| 进展期胃癌 | 133 | 9(6.8) | 41(30.8) | 83(62.4) |
| 总计 | 184 | 14(7.6) | 58(31.5) | 112(60.9) |
去除脱片组织, 可统计的癌灶有效例数为191例. 肿瘤组织PANDER表达与浸润深度有关. 局限在黏膜和黏膜下层浸润者PANDER表达高于已经浸润至肌层和浆膜层者(Mann-Whitney U test, Z = -2.52, P = 0.012, 表2); PANDER表达与其他临床病理参数未见相关.
| 病理类型 | 胃癌组织PANDER表达 | Z或χ2 | P | |||
| - | + | ++ | ||||
| 肿瘤大小 | <4.39 cm | 43(40.6) | 44(41.5) | 19(17.9) | -1.73 | 0.084 |
| >4.39 cm | 46(54.1) | 27(31.8) | 12(14.1) | |||
| 组织类型 | 中高 | 11(44.0) | 13(52.0) | 1(4.0) | 2.991 | 0.393 |
| 中 | 16(50.0) | 10(31.2) | 6(18.8) | |||
| 中低 | 56(49.1) | 39(34.2) | 19(16.7) | |||
| 印戒黏液 | 5(26.3) | 9(47.4) | 5(26.3) | |||
| 浸润深度 | 黏膜及黏膜下层 | 16(29.6) | 28(51.9) | 10(18.5) | -2.52 | 0.012a |
| 肌层及浆膜层 | 73(53.3) | 43(31.4) | 21(15.3) | |||
| 淋巴结转移 | 无 | 50(45.9) | 43(39.4) | 16(14.7) | -0.066 | 0.947 |
| 有 | 39(47.6) | 28(34.1) | 15(18.3) | |||
| TNM分期 | 0 | 8(30.8) | 9(34.6) | 9(34.6) | 5.807 | 0.121 |
| Ⅰ | 31(44.9) | 31(44.9) | 7(10.1) | |||
| Ⅱ | 26(51.0) | 18(35.3) | 7(13.7) | |||
| Ⅲ | 24(53.5) | 13(28.9) | 8(17.8) | |||
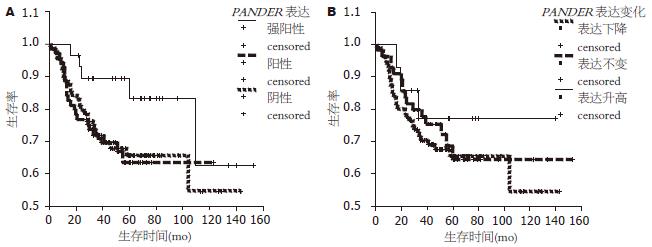
肿瘤组织中PANDER表达以及表达改变程度与胃癌预后没有显示出统计学差别, 但PANDER强阳性表达以及表达升高者生存率略高一些(P = 0.1656, 0.6108, 图3).
我们前期用基因芯片研究胃癌差异表达基因发现PANDER在多数胃癌组织中表达下降, 本研究RT-PCR结果进一步证实了这一结论, 然而, 由于是用胃癌混合组织进行的比较, 尚无法说明PANDER表达的差异是否来源于胃腺上皮细胞. 原位杂交显示该基因在胃上皮间质细胞以及平滑肌细胞中无表达或者只有弱表达, 而主要在腺上皮表达, 说明该基因的差异表达来源于胃腺上皮细胞.
总共60.9%的胃癌组织中PANDER表达相对于配对的正常黏膜组织出现下降, 而早期胃癌中即有56.9%患者出现表达下降, 与RT-PCR以及基因芯片结果吻合, 同时说明PANDER表达下降是胃癌的早期事件, 该分子在胃癌的发生机制中可能具有一定作用. Burkhardt et al用基因芯片比较转染PANDER基因前后小鼠胰岛细胞基因表达差异, 发现有60余个基因出现表达改变, 其中22个基因与细胞凋亡相关, PANDER诱导胰岛凋亡的主要机制是通过CAPS3基因激活以及CDKN1A基因表达下调后改变相应传导通路来实现, 这个凋亡诱导通路与传统凋亡通路有所不同[6], 在胃癌中该分子的表达下降可以用来解释胃癌细胞凋亡减弱, 但其机制是否与诱导胰岛细胞凋亡的CAPS3以及CDKN1A通路相同仍有待于进一步研究.
PANDER在正常胃黏膜、癌灶、淋巴结转移灶表达呈递进式下降(χ2 = 81.135, P = 0.00), 并且早期胃癌(浸润局限于黏膜层和黏膜下层)的表达要高于进展期胃癌, 说明该分子在胃癌中的表达下降还与胃癌的发展有关; 转移淋巴结灶中胃癌细胞PANDER表达的进一步表达下降可能是高转移潜能细胞的遗传特点, 也可能是转移细胞与转移灶中微环境相互作用的结果. 生存分析提示该分子在胃癌组织表达程度对预后的影响似乎要强于表达变化对预后的影响; 但该分子的表达程度与TNM分期无关, 并且对预后影响并未有统计学差异, 因此, 该分子的表达状况在胃癌进展机制中并非关键因素, 进一步扩大样本量可能得到具有统计学意义的结论.
在我们的研究中采用了配对的胃癌、正常黏膜以及转移淋巴结组织进行表达差异的比较, 有利于消除非配对病例研究中个体遗传背景的差异对结果造成的影响, 并且能够动态观察分子表达在胃癌进展中递进性的改变; 由于研究时尚未有该分子的商品化抗体, 我们设计并合成了PANDER cRNA探针进行原位杂交分析, 原位杂交可以在相对短时间得到特异性探针, 明显加快了肿瘤相关基因的筛选速度.目前我们已经获得了商品化PANDER抗体, 拟从蛋白水平进行进一步分析.
总之, 我们的研究首次提示PANDER基因在胃癌的发生、发展中可能发挥一定机制, 这是PANDER与肿瘤相关的首次报道, 虽然目前还无法说明该分子与胃癌发生、发展的因果关系, 但进一步从多种肿瘤组织中进行验证并且分析其作用机制对于揭示PANDER基因在胃癌乃至多种肿瘤中的发病机制将提供有意义的新线索.
2002年Zhu et al用蛋白质拓扑结构近似算法结合生物信息分析克隆得到的一个细胞因子类新基因家族, 该家族有4个成员, 分别命名为FAM3A, FAM3B, FAM3C, FAM3D, 他们具有共同的4个a螺旋结构及up-up-down-down的拓扑形态. 目前, 对该分子功能的研究仍相对局限于对胰岛细胞凋亡影响与机制方面.
熊斌, 教授, 武汉大学中南医院肿瘤科
初步的研究提示PANDER能通过激活CAPS3基因以及下调CDKN1A基因表达来改变相应传导通路诱导胰岛细胞的凋亡, 并且具有时间和浓度依赖性, 推测可能在Ⅰ型糖尿病胰岛细胞自身免疫损伤中发挥一定的作用.
本研究利用配对组织观察PANDER基因在正常黏膜、癌灶、淋巴结转移病灶的序贯性表达改变; 同时将原位杂交技术应用到组织芯片中, 快速验证基因芯片的结果并且进一步了解到PANDER基因在胃癌发展过程中的表达规律.
PANDER基因作为一种凋亡诱导基因, 很可能在胃癌乃至其他肿瘤中发挥作用; 对其蛋白水平的表达以及在肿瘤中的作用机制进一步研究将为肿瘤发生机制提供新的线索.
本研究设计合理, 统计学处理恰当, 论据充足, 结论明确, 较好地反映了我国或国际胃肠病学临床和基础研究的先进水平.
编辑: 师忠芳 电编:郭海丽
| 3. | Zhu Y, Xu G, Patel A, McLaughlin MM, Silverman C, Knecht K, Sweitzer S, Li X, McDonnell P, Mirabile R. Cloning, expression, and initial characterization of a novel cytokine-like gene family. Genomics. 2002;80:144-150. [PubMed] [DOI] |
| 4. | Cao X, Gao Z, Robert CE, Greene S, Xu G, Xu W, Bell E, Campbell D, Zhu Y, Young R. Pancreatic-derived factor (FAM3B), a novel islet cytokine, induces apoptosis of insulin-secreting beta-cells. Diabetes. 2003;52:2296-2303. [PubMed] [DOI] |
| 5. | Cao X, Yang J, Burkhardt BR, Gao Z, Wong RK, Greene SR, Wu J, Wolf BA. Effects of overexpression of pancreatic derived factor (FAM3B) in isolated mouse islets and insulin-secreting betaTC3 cells. Am J Physiol Endocrinol Metab. 2005;289:E543-E550. [PubMed] [DOI] |
| 6. | Burkhardt BR, Greene SR, White P, Wong RK, Brestelli JE, Yang J, Robert CE, Brusko TM, Wasserfall CH, Wu J. PANDER-induced cell-death genetic networks in islets reveal central role for caspase-3 and cyclin-dependent kinase inhibitor 1A (p21). Gene. 2006;369:134-141. [PubMed] [DOI] |
| 7. | Yang J, Gao Z, Robert CE, Burkhardt BR, Gaweska H, Wagner A, Wu J, Greene SR, Young RA, Wolf BA. Structure-function studies of PANDER, an islet specific cytokine inducing cell death of insulin-secreting beta cells. Biochemistry. 2005;44:11342-11352. [PubMed] [DOI] |