修回日期: 2008-02-29
接受日期: 2008-04-11
在线出版日期: 2008-04-18
目的: 研究Ki67和C-erbB-2在各类胃食管黏膜病变中的表达及意义.
方法: 采用TMA制作140例各类胃食管黏膜病变的组织芯片, 分成Barrett食管(BE)组、贲门癌(CA)组、食管腺癌(EA)组、和胃窦肠化(AIM)组、贲门肠上皮化生(CIM)组和正常对照(Control)组, 共6组, 采用免疫组织化学方法检测Ki67和C-erbB-2的表达.
结果: BE组, EA组和CA组Ki67的阳性率均显著高于Control组(40.9%, 69.6%, 61.9% vs 0.0%, 均P<0.01), 明显高于CIM组11.5%(P<0.05); CIM组和AIM组以及EA组和CA组之间无显著性差异; EA和CA组中Ki67的阳性率高于BE组(P<0.05); BE组, EA组和CA组C-erbB-2的阳性率均显著高于Control组和CIM组(31.8%, 52.1%, 52.4% vs 0.0%, P<0.01), 明显高于AIM组3.6%(P<0.05). C-erbB-2与Ki67在各类胃食管黏膜病变组织中的表达统计学上具有紧密关联性(P = 0.001).
结论: Ki67和C-erbB-2可能在Barrett食管和胃食管连接处腺癌的发生发展中起重要的促进作用.
引文著录: 常英, 刘贵生, 张军, 龚均. 组织芯片研究胃食管黏膜病变中Ki67和C-erbB-2的表达及意义. 世界华人消化杂志 2008; 16(11): 1184-1189
Revised: February 29, 2008
Accepted: April 11, 2008
Published online: April 18, 2008
AIM: To detect the expression of Ki67 and C-erbB-2 in esophagogastric mucosal diseases, and conclude their significances.
METHODS: Using tissue microarray technique (TMA), 140 specimens of mucosa at esophagogastric junction were divided into 6 groups: Barrett's esophagus (BE) group, cardiac adenocarcinoma (CA) group, esophageal adenocarcinoma (EA) group, antrum intestinal metaplasia (AIM) group, cardia intestinal metaplasia (CIM) group, and normal control (NC) group. Ki67 and C-erbB-2 expression were examined by immunohistochemistry (IHC).
RESULTS: The positive staining of Ki67 in BE, EA or CA group was significantly higher than that in NC group (40.9%, 69.6%, 61.9% vs 0.0%; all P < 0.01), even than that (11.5%) in CIM group (P < 0.05). Ki67 expression was not markedly different between CIM and AIM group as well as between EA and CA group, but the positive rate of Ki67 expression in EA and CA group was higher than that in BE group (P < 0.05). The positive staining of C-erbB-2 in BE, EA or CA group was significantly higher than that in NC, CIM or AIM group (31.8%, 52.1%, 52.4% vs 0.0%, 0.0%, 3.6%; P < 0.01 or P < 0.05). McNemar's test showed a significant correlation between Ki67 and C-erbB-2 expression in these diseases at esophagogastric junction (P = 0.001).
CONCLUSION: Ki67 and C-erbB-2 may play stimulative roles in the occurrence and development of Barrett's esophagus and adenocarcinoma at the esophagogastric junction.
- Citation: Chang Y, Liu GS, Zhang J, Gong J. Investigation of Ki67 and C-erbB-2 expression in esophagogastric disease and their significances by tissue microarray. Shijie Huaren Xiaohua Zazhi 2008; 16(11): 1184-1189
- URL: https://www.wjgnet.com/1009-3079/full/v16/i11/1184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i11.1184
胃食管连接处腺癌发病率近年来有上升趋势, Barrett食管(barrett's esophagus, BE)被认为是其发生的重要危险因素而倍受关注. 目前对于BE的临床诊断仍不理想, BE癌变风险的监测尚缺乏有效的手段和有用的分子生物学指标. 组织芯片技术为医学分子生物学提供了一种高通量、大样本以及快速的分析工具[1]. 我们采用组织芯片技术结合免疫组织化学技术研究了Ki67和C-erbB-2在各类胃食管连接处黏膜病变中的表达, 探索BE及其相关腺癌早期诊断的分子生物学指标.
西安交通大学第二医院病理科提供石蜡包埋正常贲门组织对照组20例, 贲门肠化组织(cardia intestinal metaplasia, CIM)组26例, BE组织组22例, 胃窦肠化组织(AIM)组28例, 食管腺癌组织(esophageal adenocarcinoma, EA)组23例, 贲门癌组织(cardia adenocarcinoma, CA)组21例. BE的诊断标准为内镜下远端食管出现柱状上皮样黏膜, 可呈全周型、岛型及舌型等, 同时活检存在肠上皮化生(intestinal metaplasia, IM); CIM的诊断标准为发生在位置正常的胃食管连接处(gastroesophageal junction, EGJ)远端2 cm范围内即贲门的肠化; EA的诊断标准为癌中心在胃食管连接处1 cm以上的食管肿瘤, 经病理证实癌细胞呈腺管结构和/或有细胞内、外黏液, 取材部位均在食管, 而不在贲门处, 并经病理证实癌灶边缘至标本上下切端之间存在鳞状上皮; CA, 即癌中心位于胃食管连接处上下2 cm内范围内的肿瘤[2-5]. 所有标本均经中性甲醛溶液固定, 按病理常规方法制成蜡块后保存备用.
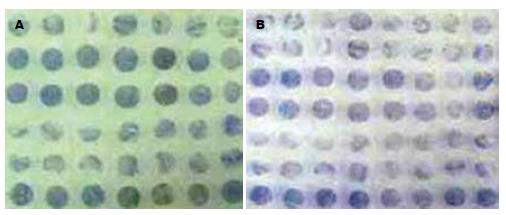
组织芯片制作由陕西超英生物医学研究开发有限公司协助制作构建两张组织芯片分别含70个位点. 常规病理切片并做HE染色行病理诊断. 阵列制作应用美国Beecher阵列仪先在一受体块(空白蜡块)上打一孔(直径1.5 mm), 然后根据HE片上所画出的精确范围, 在供体块(组织蜡块)的相应位置上准确取出所要的组织芯放入受体块的孔中, 详细记录每一孔中所放组织的编号, 重复上述操作, 制成阵列块. 切片用德国Leica切片机连续切片, 切片厚度4 µm捞片、烤片后做常规HE染色, 然后由病理专家检查组织芯片中的每一种组织是否与设计相符. 组织点阵列模块排列整齐, 经HE染色后, 个别组织点发生了脱片、易位和皱折, 但组织学可观察率仍为96.6%(图1). 另免疫组织化学染色采用超敏S-P法DAB显色. Ki-67与CerbB-2抗体免疫组化试剂盒购自华美生物技术有限公司, 阳性对照乳腺癌芯片2张. 一抗孵育条件为37℃ 1 h. 阴性对照用PBS代替一抗, 其余条件同实验片. 组织处理: Ki67, 抗原修复以0.01 mol/L枸橼酸盐缓冲液(pH6.0)高温高压15 min, C-erbB-2, 抗原修复微波处理; 均以30 g/L H2O2封闭内源性过氧化物酶, 以非免疫羊血清封闭非特异性位点, 以生物素封闭试剂封闭内源性生物素. 染色阳性信号呈棕黄色, 采用显微摄像计算机图像分析系统. 采用二级计分法, 阳性细胞计数: <5%, 0分; 5%-25%, 1分; 26%-50%, 2分; 51%-75%, 3分; >75%, 4分. 染色强度分类: 淡黄色, 1分; 黄色, 2分; 褐色, 3分. 两者计分相乘大于1者为阳性.
统计学处理 所有数据应用SPSS11.0软件分析, 各组间率的比较采用χ2检验, 计数资料采用McNemar test分析.
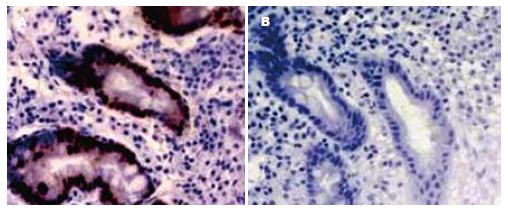
免疫组化标记显示Ki67阳性信号均位于细胞质和细胞核, 呈现粗大棕黄色颗粒. 阴性细胞核呈蓝色, 细胞质和细胞核均未着色. 各组中Ki67的阳性率见表1. Ki67的阳性率在BE组40.9%, EA组69.6%和CA组61.9%中均显著高于对照组0.0%(P = 0.0079, 0.0051, 0.0055); 并且BE组、EA组和CA组中Ki67的阳性率均明显高于CIM组11.5%(P = 0.0435, 0.0268, 0.0275); BE组、EA组和CA组中Ki67的阳性率均明显高于AIM组14.3%(P = 0.0468, 0.0352, 0.0362); EA和CA组中Ki67的阳性率高于BE组(P = 0.0374, 0.0417); CIM组和AIM组及EA组和CA组之间之间无显著性差异(P = 0.1583, 0.2153)(表1, 图2).
近年来GEJ腺癌发病率逐渐增高. Barrett食管BE被认为是其发生的重要危险因素而倍受关注. 国外研究报道BE的癌变率约为1/104人年, 较一般人群高出30-125倍, 80%的EA产生于BE, 而40%的CA与BE有关, 因此, 国外对BE的研究高度重视, 投入了大量的人力和物力. 近来研究发现, 在没有典型的BE内镜表现的患者, 在其GEJ活检也可发IM. 虽然有报道指出IM是早期EA和CA的癌旁组织常见的现象, 并且认为GEJ腺癌可能起源于CIM, 但尚无证据证明CIM是癌前病变. CIM在组织学上与远端胃黏膜IM和BE的IM相似. 起源于食管黏膜的IM和起源于贲门黏膜的IM是否均为EA和CA的癌前病变, 目前尚不清楚.
组织微阵列(tissue microarray, TMA), 又称组织芯片(tissue chip), 是1998年由Kononen et al在cDNA微阵列的基础上发明的, 一张组织芯片有序地固定着成百甚至上千个组织样本, 每个样本为圆盘状, 直径为0.6-2.0 mm, 可被用于特定的分子生物学分析, 如DNA、mRNA的原位杂交(ISH)和蛋白质的免疫组织化学(IHC)染色. 与传统方法相比, 即一张载玻片对一个患者组织样本相比, TMA的高通量是显而易见的, 而且还可以克服传统技术方法可能造成的样本和实验间的误差, TMA克服了传统病理学技术步骤繁琐、试验速度慢和效率低的缺点, 使其结果更为客观可靠. 具有小体积、多样本、大信息、可同时分析数百种组织样品的优点, 对于胃镜钳取的较小的食管黏膜标本尤其适合.
Ki67基因位于人类染色体10q25上, 分子质量为345 kDa, 在细胞G1、S、G2、M期中均有表达, 与增殖细胞核抗原(PCNA)一样为调节细胞周期存在于细胞核内的蛋白, 其表达与细胞的增生周期有关. PCNA为DNA聚合酶δ的附属蛋白, 在正常细胞中与细胞周期蛋白、CDK及P21组成复合物调节细胞由G1期向S期过渡, 而Ki67则在G1/S及G2/M转换期都可检测到变化[6-9]. 已有研究发现, Ki67抗原半衰期比PCNA明显的缩短, 检测Ki67是评估细胞增殖状态的简便方法, 比PCNA更可靠, 可作为确定癌前人群高危个体的生物标志物[10-11]. 有研究表明, Ki67异常表达与食管癌癌变过程显著相关. 靳玉兰 et al用免疫组化方法在正常组织中未发现Ki67的表达, 在轻度不典型增生的细胞中Ki67的阳性表达率为40.5%, 多分布在内基底层和外基底层, 在原位癌细胞中其阳性表达率上升到90%, 且阳性表达Ki67的细胞逐渐增多并延伸到上皮的中层及浅层[12]. Ki67表达程度与组织学分级之间等级相关分析结果呈正相关, 在正常黏膜中的表达与其在不典型增生及原位癌组织中的表达有显著性差异. 提示细胞增殖活性的提高在轻度不典型增生阶段就已发生, 而且增殖性的提高与癌变过程正相关. Reid et al[7]的前瞻性研究发现Ki67在BE高度异型增生上皮中阳性率最高, 其次为低度异型增生, 无异型增生的BE中Ki67表达水平最低. 所以推测Ki67表达改变的时相分布, 可成为在食管癌癌前人群中确立高危个体和选择重点化学预防个体的分子生物学标志. 我们研究显示: 在正常胃食管黏膜上皮组织中未发现Ki67的表达, 但是由肠化生到到腺癌的过程中, Ki67的阳性率渐增, BE组中Ki67的阳性表达率高达40.9%, 明显高于AIM组和CIM组, 多在基底和副基底层, 提示细胞增殖活性的改变在BE病变阶段就部分发生, 表明BE与胃食管连接处腺癌的发生密切相关. Ki67阳性表达的BE患者应当密切内镜随访, 以期发现重度不典型增生和早期腺癌, 及时采取内镜下治疗或者手术. Ki67的阳性率在EA和CA组时已递增到60%以上, 且阳性细胞数逐渐增多到上皮的中层及浅层, 提示Ki67在胃食管连接处腺癌的发生发展过程中起重要的作用, 因此有可能成为EA和CA的早期重要基因标记之一. 另外CIM组和AIM组Ki67的表达均明显低于BE组, 显示AIM和CIM增殖活性不高, 癌变危险性相对较低, 不必进行长期随访, 以免加重患者经济及心理负担. 虽然解剖部位及组织学上CIM组与和BE肠化相似, 但本研究结果提示他们是两个不同的来源并且可能具有不同的发病机制, CIM是否为EA和CA的癌前病变, 仍需进一步研究.
Shih et al于1981年在乙基亚硝脲诱发的大鼠神经胶质瘤中发现了癌基因neu. 其后又发现了neu基因在人类的同源基因C-erbB-2. C-erbB-2原癌基因定位于人类染色体17q21上, 其蛋白产物为p185蛋白[13-14]. C-erbB-2原癌基因在受到体内外某些因素作用下, 引起基因序列的大量扩增, 从而导致p185蛋白的过度表达, 导致肿瘤的发生、发展. C-erbB-2癌基因的蛋白产物p185蛋白与表皮生长因子受体(epidermal growth factor receptor, EGFR)间有着密切的关系. EGFR是由1186个氨基酸组成的单链跨膜蛋白, 其结构由细胞外区、跨膜区和含有酪氨酸激酶活性的细胞内区组成. 对表皮生长因子(epidermal growth factor, EGF)具有高度亲和性, 二者特异结合后, 激活酪氨酸激酶, 酪氨酸激酶可激活其他信息传递体系, 如: 激活膜上的磷脂酶C使磷脂分解, 释放出磷酸肌醇和1, 2-二脂酰甘油, 后者又可进一步激活蛋白激酶C(protein kinase C, PKC)和促使钙离子自细胞内钙库释出. PKC和钙离子均可将来自生长因子的刺激进一步传递, 起到信号扩增作用. 此外生长因子与受体结合后, 还可以增加细胞内cAMP水平. 通过cAMP和PKC等将来自生长因子的信息传至细胞内, 起到调节细胞的生长和分化作用[15]. C-erbB-2癌基因的产物p185蛋白类似一个"截断的EGFR", 因缺乏膜外的EGFR结合区和膜内部自身磷酸化部位, 使其类似活化的EGFR, 无需与EGF结合便可被激活, 传导促细胞分裂信号, 同时由于不能和EGF结合进而在细胞内降解, 以致表达后导致细胞的无节制生长. C-erbB-2癌基因被激活后, 导致p185蛋白过度表达, 产生类似EGF的作用, 增强细胞的有丝分裂, 导致细胞过度增生转化成肿瘤细胞. C-erbB-2结构改变如扩增导致过度表达, 增强有丝分裂, 在癌瘤启动阶段后期, 这种机制使某些不正常的细胞获得不受机体控制的独立生长能力. Kim et al用免疫组织化学的方法检测出C-erbB-2癌基因在高度异型增生的BE内(31%)及AE中(10%)的表达; 另一研究却发现C-erbB-2蛋白过度表达仅发生在EA中(11%), 且与EA的预后差有关, 而其周围的异型增生及BE上皮内均无表达[16]. 米建强 et al[17]对C-erbB-2癌基因产物的表达与胃癌发生的关系进行研究发现, 正常胃黏膜为阴性, 仅在腺体颈部偶见弱阳性表达, 在异型增生病变中则有较高的表达率, 并随异型增生程度的增加, 表达率逐渐升高, 轻 、中、重度异型增生表达率分别为50%, 83.3%, 85.7%, 早期及进展期胃癌中的表达率分别为22.2%和56.7%, 重度异型增生表达率显著高于早期胃癌, 进展期胃癌表达率显著高于早期胃癌, 提示C-erbB-2癌基因可能参与正常胃黏膜的增殖、修复过程并在胃黏膜异型增生及胃癌形成中充当一定角色[10]. 我们在正常组织和CIM组中未发现C-erbB-2表达, 在AIM组中较少表达(3.6%), BE组中C-erbB-2的阳性率显著高于CIM组, 提示BE发展腺癌的危险性明显高于CIM, 应加强内镜随访, CIM是否也增加胃食管连接处腺癌发生的危险性, 目前看法不一. 本研究结果示C-erbB-2表达CIM和AIM之间无显著性差异, CIM的发生可能与H. pylori相关性胃炎以及胃多灶性萎缩肠化有关, 这一结果也提示临床对BE与CIM患者应当采取不同的随访策略. Chandrasoma et al研究也发现CIM比较Barrett食管进展成腺癌的风险低[18], 与我们的研究结果一致. 另外由AIM到CIM、BE再到EA和CA组织C-erbB-2表达也呈逐步增高趋势, 提示C-erbB-2与肿瘤的发生发展过程密切相关.
C-erbB-2与Ki67表达的相关性分析结果提示, 二者表达呈正相关, 提示异常增殖的细胞中可能有p185蛋白过度表达, 产生类似EGF的作用, 增强细胞的有丝分裂, 导致细胞过度增生转化成肿瘤细胞, 可以推测二者可能对细胞癌变具有相互促进作用.
我们制作的由正常黏膜上皮、BE、CIM、AIM、CA、EA等多种病变在一起的胃食管黏膜各类病变组织芯片, 样品排列整齐, 圆形或类圆形, 较少的皱折和掉片现象, 仅用2张芯片即完成了全部实验, 极大地降低了在病理切片等操作过程中的误差, 在极短的时间内获得了胃食管黏膜各类病变中Ki67和C-erbB-2表达的诸多数据. 我们在应用cDNA微阵列技术对BE和CIM的基因表达谱差异的研究基础上[19], 进一步应用组织芯片技术对其结果进行验证, 结果提示Ki67和C-erbB-2在BE、EA、CA的发生、发展中可能起重要的促进作用, 这个结果使临床工作者面临内镜难以确诊的Barrett食管时, 可以联合动态监测Ki67和C-erbB-2的表达, 对目前临床工作中BE的正确诊断, 以及监测其癌变危险性具有客观的参考价值.
胃食管连接处腺癌发病率近年来有上升趋势, Barrett食管被认为是其发生的重要危险因素而倍受关注. 近来研究发现胃贲门部黏膜处也可出现肠上皮化生, 起源于食管黏膜的肠化和起源于贲门部黏膜的肠化是否具有共同的发病机制以及是否均为腺癌的危险因素, 目前尚不清楚.
黄晓东, 副主任医师, 武汉市中心医院消化内科
Barrett食管及其相关腺癌的发生机制尚未完全明了, 可能与多种基因的改变及异常表达造成食管上皮细胞增生与分化失常有关. 近年来研究的热点是寻找Barrett食管癌变的敏感性及特异性高的生物学指标.
有研究表明, 贲门部肠上皮化生的发生较Barrett食管肠化相对常见, 随年龄增长其发生率明显增加, 与幽门螺杆菌相关性胃炎以及胃内多处萎缩肠化有关.
本研究将组织芯片技术应用于Barrett食管癌变风险监测及相关腺癌早期诊断的研究, 构建了较大样本Barrett食管、贲门肠化组织及相关腺癌组织芯片, 并进行了Ki67和C-erbB-2的免疫组织化学研究, 为今后胃食管连接处黏膜病变相关的其他特定分子的研究提供了一个高效率的技术平台.
内镜疑诊Barrett食管时, 联合动态监测Ki67和C-erbB-2表达对临床Barrett食管的正确诊断以及监测其癌变危险性具有参考价值.
本文的科学性、创新性和可读性较好, 具有一定的参考价值.
编辑:李军亮 电编:郭海丽
| 1. | Kononen J, Bubendorf L, Kallioniemi A, Burlund M, Schraml P, Leighton S, Torhorst J, Mihatsch MJ, Sauter G, Kallioniemi OP. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med. 1998;4:844-847. [PubMed] |
| 2. | Pereira AD, Suspiro A, Chaves P, Saraiva A, Gloria L, de Almeida JC, Leitao CN, Soares J, Mira FC. Short segments of Barrett's epithelium and intestinal metaplasia in normal appearing oesophagogastric junctions: the same or two different entities? Gut. 1998;42:659-662. [PubMed] |
| 3. | Morales TG, Sampliner RE, Bhattacharyya A. Intestinal metaplasia of the gastric cardia. Am J Gastroenterol. 1997;92:414-418. [PubMed] |
| 4. | Spechler SJ. The role of gastric carditis in metaplasia and neoplasia at the gastroesophageal junction. Gastroenterology. 1999;117:218-228. [PubMed] |
| 5. | Sharma P, Weston AP, Morales T, Topalovski M, Mayo MS, Sampliner RE. Relative risk of dysplasia for patients with intestinal metaplasia in the distal oesophagus and in the gastric cardia. Gut. 2000;46:9-13. [PubMed] |
| 6. | Moch H, Schraml P, Bubendorf L, Mirlacher M, Kononen J, Gasser T, Mihatsch MJ, Kallioniemi OP, Sauter G. High-throughput tissue microarray analysis to evaluate genes uncovered by cDNA microarray screening in renal cell carcinoma. Am J Pathol. 1999;154:981-986. [PubMed] |
| 7. | Reid BJ, Sanchez CA, Blount PL, Levine DS. Barrett's esophagus: cell cycle abnormalities in advancing stages of neoplastic progression. Gastroenterology. 1993;105:119-129. [PubMed] |
| 8. | Fombonne J, Charrier C, Goddard I, Moyse E, Krantic S. Leptin-mediated decrease of cyclin A2 and increase of cyclin D1 expression: relevance for the control of prepubertal rat Leydig cell division and differentiation. Endocrinology. 2007;148:2126-2137. [PubMed] |
| 9. | Zhu Z, Zhang Q, Yu Z, Zhang L, Tian D, Zhu S, Bu B, Xie M, Wang W. Inhibiting cell cycle progression reduces reactive astrogliosis initiated by scratch injury in vitro and by cerebral ischemia in vivo. Glia. 2007;55:546-558. [PubMed] |
| 10. | Inoue T, Segawa T, Shiraishi T, Yoshida T, Toda Y, Yamada T, Kinukawa N, Kinoshita H, Kamoto T, Ogawa O. Androgen receptor, Ki67, and p53 expression in radical prostatectomy specimens predict treatment failure in Japanese population. Urology. 2005;66:332-337. [PubMed] |
| 11. | Visapaa H, Seligson D, Huang Y, Rao JY, Belldegrun A, Horvath S, Palotie A. Ki67, gelsolin and PTEN expression in sarcomatoid renal tumors. Urol Res. 2003;30:387-389. [PubMed] |
| 12. | Jin Y, Zhang W, Liu B. Abnormal expression of p53, Ki67 and iNOS in human esophageal carcinoma in situ and pre-malignant lesions. Zhonghua Zhongliu Zazhi. 2001;23:129-131. [PubMed] |
| 13. | Barnes DM, Lammie GA, Millis RR, Gullick WL, Allen DS, Altman DG. An immunohistochemical evaluation of c-erbB-2 expression in human breast carcinoma. Br J Cancer. 1988;58:448-452. [PubMed] |
| 14. | Benusiglio PR, Pharoah PD, Smith PL, Lesueur F, Conroy D, Luben RN, Dew G, Jordan C, Dunning A, Easton DF. HapMap-based study of the 17q21 ERBB2 amplicon in susceptibility to breast cancer. Br J Cancer. 2006;95:1689-1695. [PubMed] |
| 15. | Gasparini G, Gullick WJ, Bevilacqua P, Sainsbury JR, Meli S, Boracchi P, Testolin A, La Malfa G, Pozza F. Human breast cancer: prognostic significance of the c-erbB-2 oncoprotein compared with epidermal growth factor receptor, DNA ploidy, and conventional pathologic features. J Clin Oncol. 1992;10:686-695. [PubMed] |
| 16. | Kim R, Clarke MR, Melhem MF, Young MA, Vanbibber MM, Safatle-Ribeiro AV, Ribeiro U Jr, Reynolds JC. Expression of p53, PCNA, and C-erbB-2 in Barrett's metaplasia and adenocarcinoma. Dig Dis Sci. 1997;42:2453-62. [PubMed] |
| 18. | Chandrasoma PT, Der R, Ma Y, Dalton P, Taira M. Histology of the gastroesophageal junction: an autopsy study. Am J Surg Pathol. 2000;24:402-409. [PubMed] |
| 19. | Chang Y, Gong J, Liu B, Zhang J, Dai F. Gene expression profiling in Barrett's esophagus and cardia intestinal metaplasia: a comparative analysis using cDNA microarray. World J Gastroenterol. 2004;10:3194-3196. [PubMed] |