修回日期: 2006-04-12
接受日期: 2006-04-24
在线出版日期: 2006-07-08
目的: 探讨腺病毒载体介导HBV抗原基因修饰的树突状细胞(DCs)诱导抗HBV特异性CTL反应.
方法: 制备携带HBsAg、HBeAg和HBcAg基因的3种重组腺病毒Ad-HBs, Ad-HBe, Ad-HBc, 分别转染自脐带血体外诱导培养的DCs, 观察腺病毒转染DCs效率和DCs中HBV抗原的表达; 混合淋巴细胞反应(MLR)测定HBV抗原基因修饰DCs刺激同种异体T淋巴细胞增殖能力; 乳酸脱氢酶释放法检测特异性CTL细胞对HepG222.1.5靶细胞的杀伤能力.
结果: 腺病毒载体能够高效介导HBV三个抗原基因在DCs中表达, 90%以上DCs表达示踪基因EGFP, 且DCs细胞形态完整; 感染后72 h HBsAg和HBeAg含量分别为0.919和0.328(吸光度A值). MLR实验显示, HBV抗原基因修饰DCs仍然具有刺激同种异体T细胞的增殖能力, Ad-HBs转染DCs组、Ad-HBe转染DCs组、Ad-HBc转染DCs组和未转染DCs组之间刺激T细胞的增殖水平无明显差异(F = 1.194, P = 0.389); 在E:T比例为2:1, 10:1和25:1时, Ad-HBs转染DC组、Ad-HBe转染DCs组和Ad-HBc转染DCs组对HepG222.1.5细胞的杀伤率均明显高于未转染DCs组(P<0.001); 以Ad-HBc转染DC组对HepG222.1.5细胞杀伤率最高.
结论: HBV抗原基因修饰DCs疫苗具有刺激同种异体T细胞增殖能力, 同时能增强抗HBV特异性CTL反应的能力, 可能发展为一种新型抗病毒疫苗.
引文著录: 黄呈辉, 欧阳玲, 黄建国, 黎淦平, 江鹏飞, 姚集鲁. HBV抗原基因修饰树突状细胞疫苗体外抗HBV的作用. 世界华人消化杂志 2006; 14(19): 1864-1869
Revised: April 12, 2006
Accepted: April 24, 2006
Published online: July 8, 2006
AIM: To explore whether hepatitis B virus (HBV) antigen gene-modified dendritic cells (DCs) are able to induce a specific cytotoxic T lymphocyte (CTL) response.
METHODS: Three recombinant adenoviruses, Ad-HBs, Ad-HBe and Ad-HBc (carrying HBsAg, HBeAg and HBcAg genes respectively), were prepared and transfected into DCs generated from cord blood. The efficacy of transfection was observed through the expression of enhanced green fluorescent protein (EGFP) in DCs and the expression of HBV antigen were detected by enzyme-linked immunosorbent assay (ELISA). HBV antigen gene-modified DCs were co-cultured with T lymphocytes from cord blood and the proliferation of T cells were detected using mixed lymphocyte reaction (MLR). Lactate dehydrogenase (LDH) release assay was carried out to assess the killing ability of CTL cells against HepG222.1.5 cells.
RESULTS: HBV antigen genes were expressed in DCs with a high efficacy by recombinant adenoviral vector. EGFP were observed in 90% transfected DCs and DCs kept their typical forms after transfection. The titers (absorbance) of HBsAg and HBeAg were 0.919 and 0.328, respectively, in the culture supernatant 72 h after transfection. The result of MLR showed that HBV gene-modified DCs effectively stimulated naive T lymphocytes to proliferate. There was no significant difference among Ad-HBs, Ad-HBe, Ad-HBc transfection group and normal group (F = 1.194, P = 0.389). The specific CTL cells generated by HBV antigen gene-modified DCs had obvious cytotoxity against HepG222.1.5 cells, and the cytotoxity in Ad-HBs, Ad-HBe, Ad-HBc transfection group was significantly higher than that in normal group (all P < 0.001). The cytotoxity in Ad-HBc transfected group was the strongest.
CONCLUSION: HBV gene-modified DCs are able to effectively stimulate naive T lymphocytes to proliferate and enhance the specific CTL response at the same time, showing its promising future for developing anti-viral vaccine.
- Citation: Huang CH, Ou-Yang L, Huang JG, Li GP, Jiang PF, Yao JL. Induction of specific cytotoxic T lymphocyte responses against hepatitis B virus by hepatitis B virus antigen gene-modified dendritic cells. Shijie Huaren Xiaohua Zazhi 2006; 14(19): 1864-1869
- URL: https://www.wjgnet.com/1009-3079/full/v14/i19/1864.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i19.1864
在HBV感染中, 由于机体不能产生有效的细胞毒性T淋巴细胞(CTL)反应, 常导致HBV慢性持续感染. 有研究表明, 慢性乙型肝炎产生免疫耐受的原因之一是患者体内抗原提呈细胞, 尤其是树突状细胞(DCs)数量减少和功能存在缺陷, 不能将抗原信号有效提呈给机体的免疫系统而发挥免疫清除效应[1-6]. 通过提高DCs的抗原提呈功能, 诱导出更强有力的特异性免疫应答反应, 已成为抗病毒和抗肿瘤免疫治疗的一种新途径[7-10]. 我们利用整合HBV基因组的HepG222.1.5为细胞模型, 通过携带有编码HBV抗原基因的重组腺病毒载体的介导, 探讨腺病毒介导的HBV抗原基因修饰的DCs能否诱导产生特异性抗感染免疫反应, 为以DCs为基础肝炎病毒免疫治疗提供实验依据.
携带HBsAg, HBeAg和HBcAg基因的复制缺陷型重组腺病毒Ad-HBs, Ad-HBe, Ad-HBc由本室构建[11]; 重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)、重组人白介素-4(rhIL-4)、重组人白介素-2(rhIL-2)和重组人肿瘤坏死因子(rhTNF-α)购自德国ReliaTech公司; 丝裂霉素C(mitomycin C)、G418和四甲基偶氮唑蓝(MTT)购自Sigma公司; Cytotox96 Non-Radioactive Cytotoxicity Assay试剂盒(乳酸脱氢酶法)购自Promega公司; 细胞因子IL-12、IL-10和IFN-γ ELISA检测试剂盒购自深圳晶美生物公司; HBsAg ELISA检测试剂购于荷兰欧嘉隆公司, HBeAg ELISA检测试剂购于厦门新创公司; HepG222.1.5细胞系由第一军医大学附属南方医院感染科骆抗先教授惠赠. 脐带血树突状细胞的体外培养和鉴定参见文献[12]. 于培养第12天, 收集悬浮细胞, 进行电镜观察, 并在流式细胞仪上进行DC表面分子检测.
1.2.1 重组腺病毒介导HBV抗原基因转染DCs: 收集12 d的DCs, PBS液洗2次, 细胞计数, 调整至2.5×106/孔于24孔培养板上, 分别加入重组腺病毒Ad-HBs, Ad-HBe和Ad-HBc感染DCs (MOI值为80), 50 mL/L CO2, 37 ℃孵箱中孵育1 h后加完全RPMI 1640培养液继续培养, 同时设1孔未转染Ad的DCs作对照. 6 h后, 收集并洗涤2次, 去除多余的病毒, 再加含细胞因子的完全RPMI 1640培养液继续培养48-72 h, 于荧光显微镜下观察DCs中EGFP表达, ELISA检测培养上清中HBsAg和HBeAg的含量.
1.2.2 同种混合淋巴细胞反应(MLR): 取脐带血20 mL, 经淋巴细胞分离液密度梯度离心后分离获得单个核细胞, 加完全RPMI 1640培养液, 50 mL/L CO2, 37 ℃孵箱中孵育2 h后去除贴壁的单核巨噬细胞, 收集未贴壁细胞, 用免疫磁珠负选法去除B淋巴细胞, 收集获得T淋巴细胞即反应细胞. 取3种腺病毒介导HBV抗原基因修饰的DCs, 加入丝裂霉素C, 终浓度为50 mg/L, 于50 mL/L CO2, 37 ℃孵箱中孵育45 min, PBS洗2次, 完全RPMI 1640培养液悬浮, 作为刺激细胞. 分别以2×105, 4×104, 2×104细胞/孔加入96孔平底培养板中, 每组设3个复孔, 每组再加入2×105/孔的上述制备的T淋巴细胞, 总体积为200 μL, 50 mL/L CO2, 37 ℃孵育箱培养96 h. 另取PBMC作为DC阴性对照组. 采用MTT法检测T淋巴细胞增殖能力, 方法: 培养结束前6 h, 吸去孔中的培养液, 加入新鲜培养液100 μL, 再加入5 g/mL的MTT 25 μL, 轻轻混匀各孔, 50 mL/L CO2, 37 ℃孵育箱继续孵育4-6 h. 吸去孔中培养液, 使体积小于50 μL, 加入DMSO 150 μL, 振荡混匀10 min, 于620 nm检测吸光度(A值). 计算刺激指数(stimulating index, SI) = (实验组A值-本底A值)/(对照组A值-本底A值), 结果以3孔的均值表示. 另收集混合淋巴细胞反应培养96 h后的上清, 用ELISA试剂盒检测上清中的细胞因子IL-12, IL-10和IFN-γ含量.
1.2.3 CTL细胞体外杀伤活性的检测: 采用乳酸脱氢酶释放法[13]. 在24孔培养板中加入培养成熟的DCs (12 d), 分别以MOI = 80的重组腺病毒液Ad-HBs, Ad-HBe, Ad-HBc转染, 48 h后按2×106/孔加入分离的T淋巴细胞, 加入含rhIL-25 kU/L, rhGM-CSF 50 μg/L, rhIL-4 25 μg/L, rhTNF-α 5 μg/L完全RPMI 1640培养液, 50 mL/L CO2, 37 ℃孵箱培养, 隔天半量换液, 继续培养至第8天, 离心收集细胞作为效应细胞. 用胰酶消化传代HepG222.1.5细胞(靶细胞), 按5×103/孔加入96孔培养板中, 添加培养液至体积200 μL, 培养过夜. 按效应细胞:靶细胞比例分别为2:1, 10:1和25:1加入效应细胞于上述制备的靶细胞中, 每组设3个复孔. 同时设4个对照: 靶细胞最大释放组、体积校正对照组、背景对照组和自然释放组. 于50 mL/L CO2, 37 ℃孵育箱孵育4 h, 在孵育结束前45 min, 靶细胞最大释放组和体积校正对照组中加入裂解液10 μL. 之后每孔吸取上清50 μL于另一96孔酶标板中, 再加入底物混合液50 μL, 室温反应30 min, 加入50 μL终止液, 混匀后于490 nm测定A值. 计算靶细胞杀伤率(%) = (实验组释放-效应细胞自发释放-靶细胞自发释放)/(靶细胞最大释放-靶细胞自发释放)×100%.
统计学处理 数据用SYSTAT统计软件进行处理, 组间比较采用双因素方差分析F检验.
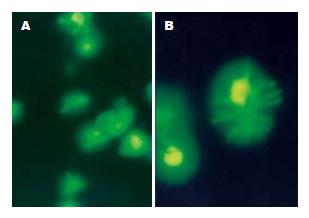
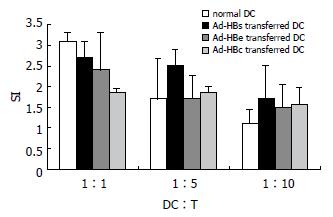
通过倒置荧光显微镜下观察显示, 3个重组腺病毒Ad-HBs, Ad-HBe和Ad-HBc感染DCs后48 h, 约90%以上DCs表达示踪基因EGFP, 且形态正常, 具有典型树突样突起(图1). 用MOI = 80的Ad-HBs和Ad-HBe重组腺病毒液感染2.5×106的DCs, 用ELISA检测培养液上清HBV抗原基因表达的HBsAg和HBeAg的分泌, 结果于感染后48 h HBsAg和HBeAg含量分别为0.719和0.161 (A值), 72 h上升为0.919和0.328. 表明重组腺病毒已经有效介导HBV抗原在DCs中表达. 为观察重组腺病毒介导HBV抗原基因修饰的DCs抗原提呈能力的变化, 我们进行同种混合淋巴细胞反应试验, 结果显示, 在DCs:T比例为1:1, 1:5和1:10时, HBV 3种抗原基因修饰DCs仍然具有很强的刺激同种异体T细胞的增殖能力. 经双因素方差统计分析, Ad-HBs转染DCs组、Ad-HBe转染DCs组、Ad-HBc转染DCs组和未转染DCs组之间刺激T细胞的增殖水平无明显差异(F = 1.194, P = 0.389>0.05, 图2).
MLR反应上清中IL-12产量以Ad-HBc转染DCs组最高, 为115±16.1 ng/L, 未转染DCs组、Ad-HBs转染DCs组和Ad-HBe转染DCs组IL-12产量差异不明显. IFN-γ分泌量在上述4组之间差异也不明显; IL-10产量以未转染DCs组最高, 为120±21.4 ng/L, 而Ad-HBc转染DCs组最低, 为80±20.7 ng/L(表1).
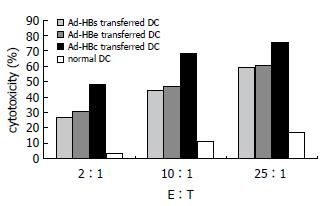
HBV抗原基因修饰DCs诱导的CTL对靶细胞HepG222.1.5具有明显的杀伤活性(图3). Ad-HBs转染DCs组、Ad-HBe转染DCs组和Ad-HBc转染DCs组对HepG222.1.5细胞的杀伤率明显高于未转染DCs组(P<0.001); 除Ad-HBs转染DCs组和Ad-HBe转染组之间对HepG222.1.5细胞杀伤率无明显差异(F = 0.534, P = 0.493>0.05)外, 其他各组之间均有明显差异(P<0.01), 以Ad-HBc转染DCs组杀伤HepG222.1.5细胞率最高.
树突状细胞是目前所知的功能最强的专职抗原提呈细胞, 也是唯一能够激活初始T淋巴细胞的抗原提呈细胞. 近年来体外大量扩增DCs的方法日益成熟, 使DCs用于抗感染免疫和抗肿瘤免疫治疗受到重视. 通过在体外扩增DCs的同时采用肿瘤或病毒抗原冲击致敏DCs, 提高DCs的抗原提呈能力, 诱导抗原特异性免疫反应来清除肿瘤细胞或病毒感染. 如何使成熟DCs负载肿瘤或病毒抗原, 是能否诱导特异性CTL产生的关键所在. 现已经有的方法有: 抗原蛋白或多肽片段与DCs共培养[14-16], 病毒载体(腺病毒、逆转录病毒、痘苗病毒等)介导[17-18], 裸DNA通过化学或物理方法转染[19]. DCs是一种终末期细胞, 用化学和物理方法转染外源基因的效率低; 逆转录病毒载体能携带外源基因整合进靶细胞的基因组内, 使目的基因长期稳定表达. 但是, 由于外源基因的插入有导致基因突变的危险, 因此存在潜在的遗传毒性. 此外, 逆转录病毒只能感染分裂增殖期的细胞, 且繁殖滴度低, 用逆转录病毒载体介导目的基因转染DCs, 效率较低[20]. 腺病毒具有转染宿主细胞广泛、能够感染静止期细胞的特点, 采用腺病毒载体介导基因修饰DCs, 已经成为转染DCs的首选病毒载体[18-19,21-22]. 我们用腺病毒E1, E3缺陷型重组腺病毒介导HBV抗原基因转染成熟DCs, 在MOI为80时, 90%以上的DCs能够表达HBV抗原蛋白, 说明腺病毒载体能够高效介导目的基因转染DCs, 转染前后DCs形态无明显改变, 也无明显毒副作用. 同时, 转染后成熟DCs仍然具有较强的刺激同种异体T淋巴细胞增殖能力和分泌细胞因子IL-12的能力, 说明重组腺病毒不影响DCs的各种功能. 提示腺病毒载体是介导目的基因转染DCs效率最高、较理想的载体.
在体外培养的条件下, 经过HBV多肽抗原或蛋白质等抗原激活DCs, 制备特异的DCs疫苗在体内外能诱导特异的抗体和CTL效应[23-25]. 但多肽存在严格的MHC限制性, 且抗原多肽的半衰期仅为2-10 h, 若要诱导出高水平的持久的抗病毒免疫效应, 则需要反复多次回输抗原多肽体外致敏的DCs. 将病毒抗原基因导入DCs, 可不受MHC限制, 能够提供更有效的抗原表位, 使DCs持续表达抗原基因产物, 从而诱导特异性CTL反应. 在DCs疫苗抗肿瘤治疗研究中发现, 利用基因转导方法, 以编码肿瘤抗原基因载体对DCs骨髓前体细胞进行转导, 再辅以GM-CSF和IL-4培养, 能产生大量表达TAA或TSA的DCs[26]. 这种DCs在动物模型中能诱导抗原特异的CTL反应, 减少肿瘤肺转移率, 延长生存期. HBV的3个抗原都具有很强的免疫原性, 具有潜在T淋巴细胞激活表位, 能介导CTL细胞发挥抗HBV作用. 我们通过腺病毒介导HBsAg、HBeAg和HBcAg基因于DCs中, 显示三者均可以诱导产生特异性CTL反应, 高于未用HBV抗原基因刺激DCs的对照组. 在介导CTL反应中, 以HBcAg组作用最强, HBsAg、HBeAg次之, 与文献报道相近似[27-28]. 造成诱导的CTL反应强弱不等的原因, 一是在HBV抗原系统中, 以HBcAg具有最强的T淋巴细胞刺激表位, T淋巴细胞免疫原性最强; 另外, 我们选择HepG222.1.5细胞作为攻击的靶细胞, 经ELISA检测发现, 该细胞株HBsAg的表达较弱, 而HBeAg和HBcAg的表达较强. 检测MLR和诱导CTL生成上清液中IL-12、IFN-γ分泌水平也显示, Ad-HBc组刺激T淋巴细胞分泌IL-12水平最高, 因而其介导的特异性细胞免疫反应最强. 本研究结果初步显示, 用携带HBV抗原基因的腺病毒作为载体转染DCs, 不但可以使DCs得到高效转染, 而且可持续表达该抗原, 使抗原在DCs内得到有效加工处理, 以多个抗原表位提呈给T淋巴细胞, 可以产生特异性抗HBV感染免疫反应, 表明DCs疫苗可能发展成为一种新型抗HBV感染的治疗性疫苗.
HBV感染常导致慢性持续感染, 有研究表明, 慢性乙型肝炎产生免疫耐受的原因之一是患者体内抗原提呈细胞, 尤其是树突状细胞(DCs)数量减少和功能存在缺陷, 不能将抗原信号有效提呈给机体的免疫系统而发挥免疫清除效应. 通过提高DCs的抗原提呈功能, 诱导出更强有力的特异性免疫应答反应, 已成为抗病毒和抗肿瘤免疫治疗的新途径.
DCs抗HBV感染已经成为抗病毒免疫治疗的研究新热点, 但目前多使用多肽抗原刺激DCs以提高抗原提呈能力, 但多肽存在严格的MHC限制性, 且抗原多肽的半衰期仅为2-10 h, 要诱导出高水平的持久的抗病毒免疫效应, 则需要反复多次回输抗原多肽体外致敏的DCs.
本实验制备3种分别携带HBV抗原基因和绿色荧光蛋白(GFP)的重组非复制型腺病毒, 采用脐带血来源分离诱导培养DCs, 并用腺病毒介导HBV抗原转染DCs, 成功制备脐带血来源的DCs治疗性疫苗, 目前国内外文献还未见报道.
用重组腺病毒介导HBV抗原基因修饰DCs, 体外成功诱导特异性CTL反应, 为DCs预苗的抗HBV慢性感染的临床治疗提供了实验基础, 也为HBV治疗提供一种新的治疗手段和思路, 将造福千千万万的HBV感染者.
基因修饰: 将外来的基因通过基因转导技术导入细胞, 从而使细胞获得新的基因性状.
本文作者在体外构建了携带HBsAg、HBeAg和HBcAg基因的3种重组腺病毒, 分别转染来自脐带血的经培养树突状细胞, 结果显示具有80%的转染率. 在此基础上作者研究了树突状细胞表达HBV抗原能力及经HBV抗原基因修饰DCs刺激同种异体T淋巴细胞增殖能力和乳酸脱氢酶释放法检测特异性CTL细胞对HepG222.1.5靶细胞的杀伤能力. 试验设计合理, 结果较理想, 为以HBV抗原基因修饰DCs疫苗发展提供了试验依据和理论基础, 具有创新性和实用性.
电编:张敏 编辑:潘伯荣
| 1. | Beckebaum S, Cicinnati VR, Zhang X, Ferencik S, Frilling A, Grosse-Wilde H, Broelsch CE, Gerken G. Hepatitis B virus-induced defect of monocyte-derived dendritic cells leads to impaired T helper type 1 response in vitro: mechanisms for viral immune escape. Immunology. 2003;109:487-495. [PubMed] [DOI] |
| 2. | Hasebe A, Akbar SM, Furukawa S, Horiike N, Onji M. Impaired functional capacities of liver dendritic cells from murine hepatitis B virus (HBV) carriers: relevance to low HBV-specific immune responses. Clin Exp Immunol. 2005;139:35-42. [PubMed] [DOI] |
| 3. | Duan XZ, Wang M, Li HW, Zhuang H, Xu D, Wang FS. Decreased frequency and function of circulating plasmocytoid dendritic cells (pDC) in hepatitis B virus infected humans. J Clin Immunol. 2004;24:637-646. [PubMed] [DOI] |
| 4. | Wang FS, Xing LH, Liu MX, Zhu CL, Liu HG, Wang HF, Lei ZY. Dysfunction of peripheral blood dendritic cells from patients with chronic hepatitis B virus infection. World J Gastroenterol. 2001;7:537-541. [PubMed] [DOI] |
| 5. | Wong YQ, Qiu SJ, Tang ZY, Ye SL, Liu YK, Fan J, Sun RX, Zhao Y. Changes in the immune function of dendritic cells (DC) derived from HBV-related hepatocellular carcinoma (HCC) patient's peripheral blood monocytes (PBMC) pulsed with tumor antigen. Zhonghua Ganzangbing Zazhi. 2005;13:339-342. [PubMed] |
| 6. | Duan XZ, Zhuang H, Wang M, Li HW, Liu JC, Wang FS. Decreased numbers and impaired function of circulating dendritic cell subsets in patients with chronic hepatitis B infection (R2). J Gastroenterol Hepatol. 2005;20:234-242. [PubMed] [DOI] |
| 7. | Oh ST, Kim CH, Park MY, Won EH, Sohn HJ, Cho HI, Kang WK, Hong YK, Kim TG. Dendritic cells transduced with recombinant adenoviruses induce more efficient anti-tumor immunity than dendritic cells pulsed with peptide. Vaccine. 2006;24:2860-2868. [PubMed] [DOI] |
| 8. | Yamanaka R, Honma J, Tsuchiya N, Yajima N, Kobayashi T, Tanaka R. Tumor lysate and IL-18 loaded dendritic cells elicits Th1 response, tumor-specific CD8+ cytotoxic T cells in patients with malignant glioma. J Neurooncol. 2005;72:107-113. [PubMed] [DOI] |
| 9. | Nakamura M, Iwahashi M, Nakamori M, Ueda K, Ojima T, Naka T, Ishida K, Yamaue H. Dendritic cells transduced with tumor-associated antigen gene elicit potent therapeutic antitumor immunity: comparison with immunodominant peptide-pulsed DCs. Oncology. 2005;68:163-170. [PubMed] [DOI] |
| 10. | Chen M, Li YG, Zhang DZ, Wang ZY, Zeng WQ, Shi XF, Guo Y, Guo SH, Ren H. Therapeutic effect of autologous dendritic cell vaccine on patients with chronic hepatitis B: a clinical study. World J Gastroenterol. 2005;11:1806-1808. [PubMed] [DOI] |
| 11. | 黄 呈辉, 欧阳 玲, 马 会慧, 汤 正好, 李 刚, 姚 集鲁. 细菌内同源重组法构建HBV S区和C区基因非复制型腺病毒载体及其体外表达. 世界华人消化杂志. 2003;11:438-441. [DOI] |
| 12. | 欧阳 玲, 黄 呈辉, 黄 建国, 姚 集鲁. 脐带血中衍生树突状细胞及其生物学特性的研究. 现代临床医学生物工程学杂志. 2004;10:103-108. |
| 13. | Jackson M, Smith B, Bevitt DJ, Steward M, Toms GL, Bassendine MF, Diamond AG. Comparison of cytotoxic T-lymphocyte responses to hepatitis C virus core protein in uninfected and infected indivi-duals. J Med Virol. 1999;58:239-246. [PubMed] [DOI] |
| 14. | Furukawa S, Akbar SM, Hasebe A, Horiike N, Onji M. Production of hepatitis B surface antigen-pulsed dendritic cells from immunosuppressed murine hepatitis B virus carrier: evaluation of immunoge-nicity of antigen-pulsed dendritic cells in vivo. Immunobiology. 2004;209:551-557. [PubMed] [DOI] |
| 15. | Xing LH, Wang FS, Zhu CL. Antiviral effect of human CTLs activated by HBsAg stimulated dendritic cells in vitro. Zhonghua Shiyan He Linchuangbingduxue Zazhi. 2003;17:365-368. [PubMed] |
| 16. | Fazle Akbar SM, Furukawa S, Onji M, Murata Y, Niya T, Kanno S, Murakami H, Horiike N. Safety and efficacy of hepatitis B surface antigen-pulsed dendritic cells in human volunteers. Hepatol Res. 2004;29:136-141. [PubMed] [DOI] |
| 17. | Ding CL, Yao K, Zhang TT, Zhou F, Xu L, Xu JY. Generation of cytotoxic T cell against HBcAg using retrovirally transduced dendritic cells. World J Gastroenterol. 2003;9:1512-1515. [PubMed] [DOI] |
| 18. | Qiu SJ, Lu L, Qiao C, Wang L, Wang Z, Xiao X, Qian S, Fung JJ, Ye SL, Bonham CA. Induction of tumor immunity and cytotoxic t lymphocyte responses using dendritic cells transduced by adenoviral vectors encoding HBsAg: comparison to protein immunization. J Cancer Res Clin Oncol. 2005;131:429-438. [PubMed] [DOI] |
| 19. | Dietz AB, Vuk-Pavlovic S. High efficiency adenovirus-mediated gene transfer to human dendritic cells. Blood. 1998;91:392-398. [PubMed] |
| 20. | Lin CM, Wang FH. Selective modification of antigen-specific CD4(+) T cells by retroviral-mediated gene transfer and in vitro sensitization with dendritic cells. Clin Immunol. 2002;104:58-66. [PubMed] [DOI] |
| 21. | Lei CL, Huang CH, Yang Z, Tang XP. Expression of HBV preS2/S gene in mammalian cells transferred with adenoviral vector. Zhonghua Shiyan He Linchuangbingduxue Zazhi. 2005;19:55-57. [PubMed] |
| 22. | Huang Y, Chen Z, Jia H, Wu W, Zhong S, Zhou C. Induction of Tc1 response and enhanced cytotoxic T lymphocyte activity in mice by dendritic cells transduced with adenovirus expressing HBsAg. Clin Immunol. 2006;119:280-290. [PubMed] [DOI] |
| 23. | Shimizu Y, Guidotti LG, Fowler P, Chisari FV. Dendritic cell immunization breaks cytotoxic T lymphocyte tolerance in hepatitis B virus transgenic mice. J Immunol. 1998;161:4520-4529. [PubMed] |
| 24. | Zhang HH, He Y, Zhao H, Piao WH, Liu MC, Xi HL, Yu M, Wang GQ. The effect of stimulation of dendritic cell on HBV-epitopic cytotoxic T-lympho-cyte. Zhonghua Yixue Zazhi. 2005;85:1171-1176. [PubMed] |
| 25. | Li RB, Chen HS, Xie Y, Fei R, Cong X, Jiang D, Wang SX, Wei L, Wang Y. Dendritic cells from chronic hepatitis B patients can induce HBV antigen-specific T cell responses. World J Gastroenterol. 2004;10:1578-1582. [PubMed] [DOI] |
| 26. | Tuting T, Storkus WJ, Lotze MT. Gene-based strategies for the immunotherapy of cancer. J Mol Med. 1997;75:478-491. [PubMed] [DOI] |
| 27. | You Z, Huang XF, Hester J, Rollins L, Rooney C, Chen SY. Induction of vigorous helper and cytotoxic T cell as well as B cell responses by dendritic cells expressing a modified antigen targeting receptor-mediated internalization pathway. J Immunol. 2000;165:4581-4591. [PubMed] [DOI] |
| 28. | Qian S, Shi M, Zhang H, Zhang B, Xu DP, Wang FS. Phenotype and function of myeloid dendritic cells pulsed with hepatitis B virus antigens in patients with HBV-associated hepatocellular carcinoma. Zhonghua Yixue Zazhi. 2005;85:248-252. [PubMed] |