修回日期: 2004-11-21
接受日期: 2004-11-29
在线出版日期: 2005-02-15
目的: 明确三种中药有效成分三七皂甙(PNS)、黄芪皂甙(As)及黄芩甙(Ba)单用或配伍应用对永生化的人胃黏膜上皮细胞GES-1以及经过甲基硝基亚硝基胍(MNNG)转化后的GES-1细胞(MC细胞)增生能力的影响.
方法: 以MNNG转化GES-1细胞, 转化后细胞简称MC细胞. 分别以不同浓度的三七皂甙、黄芪皂甙及黄芩甙处理GES-1细胞及MC细胞, 四甲基谷氮唑盐(MTT)法及软琼脂集落形成试验检测三种药物单用及配伍对细胞增生活性的影响. Annexin V及PI双染, 流式细胞仪检测三药单用及配伍对MC细胞凋亡/坏死的影响; 电镜和Hoechst33258及PI双染荧光显微镜观察凋亡细胞形态.
结果: PNS、AS及Ba对GES-1和MC细胞的增生活性有明显的抑制作用, 并有随剂量增加作用增强的趋势. 三药配伍应用对2种细胞的抑制作用增强(P<0.05或P<0.01vs三药单用组), 还能明显抑制MC细胞的软琼脂集落形成能力(P<0.05或P<0.01vs MC细胞对照组). 三药单用可引起MC细胞凋亡及死亡比例增加并呈一定的时间依赖性, 配伍应用作用强于单独应用(P<0.05或P<0.01vs三药单用组), 增强程度从大至小依次为PNS+AS+Ba>PNS+AS>AS+Ba>PNS+Ba.
结论: 三种中药有效成分单用及配伍可显著抑制MC细胞的增生并引起细胞死亡; 引起细胞死亡的机制部分是通过诱导凋亡实现的; 不同药物配伍应用的增效程度不同.
引文著录: 石雪迎, 赵凤志, 由江峰, 戴欣, 王洁良, 崔湘琳, 邵宏权. 中药有效成分对甲基硝基亚硝基胍转化的人胃黏膜上皮细胞的毒性作用. 世界华人消化杂志 2005; 13(4): 477-482
Revised: November 21, 2004
Accepted: November 29, 2004
Published online: February 15, 2005
AIM: To investigate the cytotoxic effects of Panax Notogengsing Saponin (PNS), Astragalin Saponin (AS) and Baicalin (Ba), the main active components from 3 Chinese herbal medicines, on an immortalized human gastric epithelial cell line GES-1 and the N-methyl-N-nitro-N- nitrosoguanidine (MNNG) transformed GES-1 cells (MC cells).
METHODS: GES-1 cells were transformed by 2×10-5 mol/L MNNG. The transformed cells were named as MC cells. MC cells were treated with the 3 medicines alone or in different combinations. Cell viability was detected by MTT assay and soft agar colony formation assay, while apoptosis/necrosis were determined by electron microscopy, fluoroscopy and flow cytometry with annexin V staining.
RESULTS: PNS, AS and Ba inhibited the growth of GES-1 and MC cells in a dose and time-dependent manner. The colony formation efficiency in soft agar of MC cells was also decreased after treated with PNS, AS, Ba alone or in combination (P<0.05 or P<0.01vs control group). The 3 medicines induced apoptosis and/or necrosis of MC cells time-dependently. These effects were greatly enhanced when two or three of these medicines were used together (P<0.05 or P<0.01 vs 3 medicines used alone). The most potent combination was PNS+AS+Ba, followed by PNS+AS, AS+Ba and PNS+Ba, in a decreasing order.
CONCLUSION: PNS, AS and Ba can inhibit cell growth and induce cell death on MC cells. The cell death is partially caused by cell apoptosis. These effects can be enhanced to different extent by different combinations of these drugs.
- Citation: Shi XY, Zhao FZ, You JF, Dai X, Wang JL, Cui XL, Shao HQ. Cytotoxic effects of the main active components from three Chinese herbal medicines on N-methyl-N-nitro-N-nitrosoguanidine transformed GES-1 cells. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 477-482
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/477.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.477
胃癌前病变较常见, 与胃癌发生关系密切. 近年来脾虚、血瘀、热毒病机在胃癌前病变发生中的作用日益受到重视, 益气活血清热法则是针对胃癌前病变关键病机的治疗法则[1-4]. 我们观察了黄芪皂甙、三七皂甙及黄芩甙对胃癌前病变细胞增生能力的影响.
DMEM/F12培养基、标准胎牛血清、新生牛脑垂体提取物、人表皮生长因子、HEPES美国Gibco公司产品. 甲基硝基亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine, MNNG)、胰岛素、转铁蛋白、三碘甲状腺原胺酸、霍乱毒素、磷酸乙醇胺、四甲基谷氮唑盐(MTT)、碘化丙啶(propidine iodide, PI)、Hoechst33258美国Sigma公司产品. Annexin V凋亡试剂盒北京宝赛试剂公司产品. 其余试剂均为国产分析纯. CO2培养箱美国NAPCO-5410型. 酶标仪美国Bio-RAD公司550型. 倒置相差显微镜日本OLYMPUS IMT-2型. FACScan流式细胞仪美国BD公司. 永生化人胚胃黏膜细胞GES-1由北京市肿瘤研究所遗传室建系并提供. PNS, Ba购自云南植物药业有限公司. AS由北京中医药大学药学院植化室制备. DMEM/F12培养基加青、链霉素各10万U/L, 调pH值至7.4, 22 mm微孔滤膜过滤除菌, 制成基础培养基. 临用前在基础培养基内加入多种微量元素、营养成分及生长因子等[5], 制成完全培养基. GES-1细胞以完全培养基常规培养于含5% CO2的培养箱, 达80%融合后, 以1:2或1:3比例传代. 按参考文献方法[5], 以2×10-5 mol/L MNNG转化细胞. 转化后细胞常规培养传至第4代时全部冻存(简称MC细胞), 以后实验均以此细胞与GES-1细胞同时复苏传代后进行.
1.2.1 中药对GES-1和MC细胞增生的影响: GES-1细胞常规培养达80%融合时, 胰酶消化收集细胞, 6×103个/孔接种于96孔板, 24 h后换不同浓度含药培养基作用24 h, 加入MTT(终浓度80 mg/L)孵育4 h后, 吸净孔内液体, 加入DMSO 150 mL/孔, 避光振荡5 min, 酶标仪595 nm读取A值, 以不加细胞只加完全培养基的阴性对照孔平均值调零. 根据预试验结果确定给药浓度分别为: (1)PNS 20, 50, 100, 200, 300 mg/L; (2)AS 20, 50, 100, 150, 200 mg/L; (3)Ba 10, 25, 50, 75, 100 mg/L. 每组设4个平行孔, 以不含药物的完全培养基培养细胞作为对照组. 抑制率 = (对照组A值-给药组A值)/对照组A值×100%.
根据24 h时的剂量-效应曲线求出各药对GES-1细胞的IC30及IC60浓度, 以各药的IC30浓度为配伍实验剂量, MTT法检测3药两两配伍或3药共用对GES-1和MC细胞的增生抑制作用, 并与各药IC60浓度的抑制作用进行比较. 细胞接种浓度为6×103个/孔, 检测时间点为24、48和72 h, 每组设6个平行孔, 每天换液1次.
1.2.2 中药对MC细胞软琼脂集落形成能力的影响: MC细胞常规消化传代, 接种于25 mL玻璃培养瓶内, 培养24 h后去除未贴壁细胞, 以各药IC30浓度单用及配伍作用48 h后, 胰酶消化各组细胞, 收集入离心管低速离心(500 r/min)以去除死亡细胞, 胎盘蓝染色计数活细胞数>95%.以含3.3 g/L琼脂糖的完全培养基制成细胞悬液, 注入已铺好底层琼脂的6孔培养板中, 每孔1 000个细胞, 每组3孔, CO2培养箱培养2 wk后, 镜下观察计数集落形成数. 软琼脂集落形成率 = 每孔集落数/接种细胞数×100%.
1.2.3 细胞凋亡检测: MC细胞常规培养达80%融合时按1:3比例传代, 接种于100 mL培养瓶, 24 h后去除未贴壁细胞, 分别加入不同的含药培养基(PNS200 mg/L, AS100 mg/L, Ba30 mg/L单独或配伍应用)作用24 h及48 h后收集细胞进行相关检测, 以常规培养MC细胞作为阴性对照. PI/Hoechst33258双染荧光显微镜观察凋亡细胞形态: 实验到期后, 胰酶消化收集细胞及培养上清, PBS洗涤2次, 加入Hoechst33258染液(终浓度10 mg/L)及PI染液(终浓度25 mg/L)37 ℃孵育15 min, PBS洗涤后滴加细胞悬液于载玻片上, 荧光显微镜观察. 透射电镜观察凋亡细胞形态: 实验到期后, 用自制橡胶细胞刮将贴壁细胞刮下, PBS洗涤2次, 将细胞团收集到1.5 mL Eppendorf管内, 40 g/L戊二醛、19 g/L锇酸双固定PBS洗3次, 梯度酒精脱水, 低密度环氧树脂包埋, 超薄切片机切片, 醋酸双氧铀和枸橼酸铅双重染色, 透射电镜观察. Annexin V/PI双染, 流式细胞仪检测凋亡细胞比例: 实验到期后, 胰酶消化收集细胞及培养上清, 按试剂盒说明制备细胞, 流式细胞仪检测. Annexin V(+)/PI(-)细胞为凋亡细胞, Annexin V(+)/PI(-)及Annexin V(+)/PI(+)细胞之和为死亡细胞总数.
统计学处理 采用SPSS11.0软件进行数据分析, 结果以mean±SD表示, 组间均数比较采用One Way-ANOVA检验.
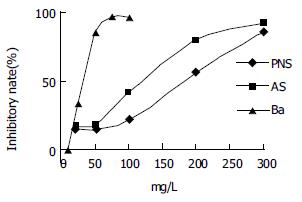
在一定剂量范围内, PNS, AS, Ba单独应用对GES-1细胞有不同程度的增生抑制作用, 且随浓度增加抑制作用增强. 各药较高浓度可产生明显的杀伤作用, 引起绝大多数细胞死亡. 以24 h时的抑制率绘制剂量-效应曲线(图1), 粗测各药对GES-1细胞的IC30及IC60浓度分别约为: PNS 130和210 mg/L; AS 90和125 mg/L; Ba 25和40 mg/L.PNS 130和210 mg/L, AS 90和125 mg/L, Ba 25和40 mg/L对GES-1及MC细胞均有明显的抑制作用, 且随浓度增大、作用时间延长抑制作用增强. 两两配伍作用(PNS 130 mg/L+AS 90 mg/L, PNS 130 mg/L+Ba 25 mg/L或AS 90 mg/L +Ba 25 mg/L)对2种细胞的抑制较单独作用明显增强(P<0.01), 且抑制率均不同程度地高于PNS 210 mg/L, AS 125 mg/L或Ba 40 mg/L. 三药共用(PNS 130 mg/L+AS 90 mg/L+Ba 25 mg/L)对2种细胞的抑制作用较两两配伍更为明显(表1, 2).
| t/h | PNS 130 mg/L | PNS 210 mg/L | AS 90 mg/L | AS 125 mg/L | Ba 25 mg/L | Ba 40 mg/L | P+A | P+B | A+B | P+A+B |
| 24 | 31.6±2.1 | 59.9±4.0a | 32.3±6.8 | 57.2±4.8b | 33.3±6.6 | 60.4±1.2c | 78.6±1.6abde | 61.3±1.2ac | 71.1±1.2bcef | 83.3±5.4abcdef |
| 48 | 40.0±3.4 | 63.7±2.7a | 39.0±2.1 | 72.1±3.0b | 40.5±2.6 | 64.6±4.9c | 85.6±1.0abde | 72.2±2.6acdf | 83.2±3.2bcef | 87.9±3.6abcdef |
| 72 | 41.5±1.5 | 75.9±0.6a | 41.6±1.5 | 81.2±0.9b | 43.7±0.7 | 85.8±1.1c | 94.2±0.2abde | 79.4±1.2acdf | 92.3±0.3bcef | 95.6±0.6abcdef |
| t/h | PNS 130 mg/L | PNS 210 mg/L | AS 90 mg/L | AS 125 mg/L | Ba 25 mg/L | Ba 40 mg/L | P+A | P+B | A+B | P+A+B |
| 24 | 36.9±1.4 | 68.0±2.2a | 29.0±3.0 | 49.5±2.7b | 27.9±1.5 | 56.5±1.3c | 73.4±0.9abde | 67.1±2.6ac | 64.3±2.4bcef | 83.0±4.5abcdef |
| 48 | 36.0±2.8 | 68.5±3.0a | 33.6±4.4 | 72.8±2.2b | 36.1±3.8 | 82.8±7.3c | 90.4±0.4abde | 78.7±1.7acdf | 87.3±0.6bcef | 92.7±2.4abcdef |
| 72 | 36.1±2.1 | 81.8±1.2a | 50.1±2.2 | 83.4±1.5b | 56.6±1.1 | 88.6±0.3c | 94.9±0.4abde | 83.5±0.3acdg | 94.2±0.1bcef | 96.2±0.8abcdef |
PNS 130 mg/L, AS 90 mg/L 及Ba 25 mg/L处理组细胞软琼脂集落形成率明显下降, 显著低于常规培养的MC细胞(P<0.01).PNS 130 mg/L+Ba 25 mg/L和AS 90 mg/L +Ba 25 mg/L处理组仅见1, 2个集落形成, PNS 130 mg/L+AS 90 mg/L和PNS 130 mg/L+AS 90 mg/L+Ba 25 mg/L处理组细胞则未见集落形成(表3).
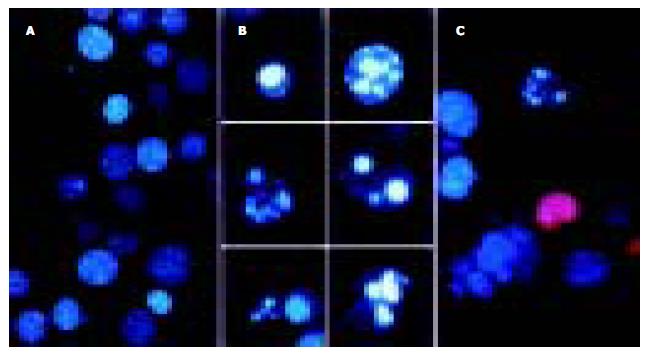
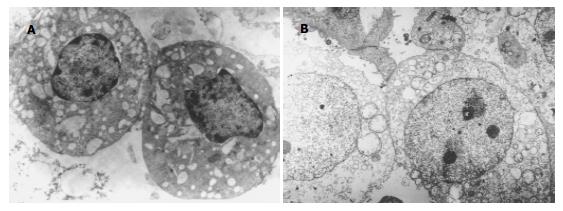
阴性对照组荧光显微镜下仅见个别Hoechst33258浓染的凋亡细胞及PI着染的死亡细胞, 而各药物处理组凋亡及死亡细胞均明显增多, 以三药合用及PNA+AS组凋亡及死亡细胞增多最为明显(图2). 在透射电镜下阴性对照组细胞呈圆形或卵圆形, 核浆比较大, 部分核膜内陷, 核形状不规则, 核分裂相易见, 胞质内细胞器很少, 细胞表面可见微绒毛, 很难找到凋亡细胞. 不同药物处理组部分细胞表面微绒毛减少, 可见数量不等的、处于不同阶段的凋亡细胞. 凋亡早期细胞染色质沿核膜下聚集, 胞质基质电子密度增高, 细胞器多保持完好, 细胞膜完整; 进而染色质凝结成团块状, 胞质明显空泡化; 最后细胞分散形成凋亡小体. 此外, 各组均可见胞质胞核明显肿胀、胞膜不完整的死亡细胞. 凋亡及死亡细胞数量三药合用及PNA+AS组凋亡及死亡细胞增多最为明显(图3). 经三种药物分别处理后, 流式细胞仪检测各处理组MC细胞均出现了不同程度的Annexin V阳性/PI阴性的凋亡细胞及死亡细胞比例增多, 且随时间延长作用更明显, 但与对照组比较无明显统计学差异. 三种药物配伍应用则凋亡细胞及死亡细胞比例增多更为显著, 与对照组比较差异有统计学意义(P<0.01, 表4).
| 分组 | Apoptotic cells | Dead cells | ||
| 24 h | 48 h | 24 h | 48 h | |
| 对照 | 2.41±0.41 | 4.56±1.59 | 7.52±1.50 | 8.96±3.09 |
| PNS 200 mg/L | 4.30±1.37 | 12.69±5.77 | 11.88±4.23 | 18.71±4.61b |
| AS 100 mg/L | 4.98±2.08 | 9.23±0.82 | 12.16±0.66 | 16.10±0.34a |
| Ba 30 mg/L | 8.56±1.61 | 13.05±1.06 | 20.58±2.67 | 25.84±2.95b |
| P+A | 19.60±8.31b | 38.79±16.05b | 69.54±6.60b | 92.96±5.44b |
| P+B | 9.49±3.57 | 15.98±6.01 | 30.41±3.31b | 35.28±5.16b |
| A+B | 19.07±11.38b | 23.72±9.97a | 50.67±19.87b | 61.69±5.29b |
| P+A+B | 15.96±3.92b | 40.71±16.57b | 91.74±0.54b | 98.42±1.26b |
脾虚、血瘀、热毒病机在胃癌前病变发生中的作用日益受到重视, 益气活血清热法则成为防治胃癌前病变重要治疗法则之一[1-4]. 我们研究了黄芪皂甙、三七皂甙及黄芩甙对不同转化程度的胃黏膜细胞增生能力的影响, 以期从细胞水平部分阐明益气活血清热法治疗胃癌前病变的机制. GES-1细胞系是由原代培养的人胎儿胃黏膜上皮细胞转染了SV-40病毒后获得的永生化细胞系, 对体外研究胃黏膜癌变机制有较大价值[6].MNNG具有较强的致癌性[7-11]. 大剂量MNNG使GES-1细胞表型发生一些改变, 如染色体畸变增多、骨架微丝异常、克隆形成率增加, 并获得软琼脂集落形成能力, 但仍不能在裸鼠体内致瘤[12-13], 因此GES-1细胞和MC细胞代表着癌变的不同阶段. 已有研究证实, Ba具有抗突变作用[14-15], 对白血病和前列腺癌细胞具有抑制增生和促进凋亡的作用[16-21], 而Chou et al[22]认为Ba对Hep3B细胞没有明显的诱导凋亡作用, 并对由TGFb1诱导的caspase-3激活和凋亡有抑制作用. AS对肿瘤细胞生长的直接影响目前尚未见报道, 仅有研究认为AS能刺激脾细胞活性, 增强PHA或ConA诱导的脾细胞抗瘤活性[23]. 本结果首次证明, AS和Ba在一定浓度范围内对GES-1细胞和MC细胞有显著的增生抑制作用, 并且使MC细胞软琼脂集落形成能力降低、细胞的锚着依赖性增强. 有研究表明, PNS中含有的Rg3能抑制前列腺癌细胞增生, 将细胞阻滞于G1期, 继而引起细胞凋亡[24-25]. 我们也发现, PNS对GES-1细胞以及经甲基硝基亚硝基胍(MNNG)转化的GES-1细胞有明显的增生抑制和促凋亡作用[5,26]. 具有益气活血清热作用的黄芪、三七和黄芩有可能是通过直接抑制异型增生细胞的过度增生而发挥治疗作用的. 我们还发现, 三种药物有效成分配伍应用对细胞的增生抑制作用增强, 两两配伍作用强于单独应用, 三药共用作用强于两两配伍. 两两配伍中又以PNS与AS合用抑制作用增强最为明显. 推测三种药物有可能通过不同途径抑制细胞增生, 所以联合用药产生协同作用的程度有所不同.
磷脂酰丝氨酸外翻分析已经成为检测早期细胞凋亡的常用方法[27]. 正常情况下, 磷脂酰丝氨酸(Phosphatidylserine, PS)位于细胞膜的内侧, 而在细胞凋亡的早期, PS可从细胞膜的内侧翻转到细胞膜的表面, 暴露在细胞外环境中[28]. 这一变化可被巨噬细胞识别, 从而使凋亡细胞被迅速吞噬[29-30].Annexin-V是一种Mr 35 000-36 000的Ca2+依赖性磷脂结合蛋白, 能与PS特异性结合. 以荧光素标记的Annexin-V作为荧光探针, 可通过流式细胞仪检测细胞凋亡的发生. 核酸染料PI不能透过完整的细胞膜, 但在凋亡中晚期的细胞和死细胞, 由于细胞膜的完整性受到破坏, 使得PI能够透过细胞膜着染细胞核. 因此将Annexin-V与PI联合使用, 就可以将凋亡早期细胞与凋亡晚期细胞和死亡细胞区分开来. 本研究的流式细胞检测结果提示, PNS、AS及Ba对MC细胞有一定程度的促凋亡作用, 且随时间延长作用有增强的趋势, 但作用48 h时与对照组比较尚无统计学意义, 可能进一步延长作用时间三药的促凋亡效果将更为显著. 与三药单用相比, 三药配伍应用促凋亡效果显著增强, 不同配伍促凋亡效果增强程度与MTT实验结果一致, 以PNS与AS合用作用增强最为明显. 另外, 流式细胞检测结果也显示, 各处理组除了凋亡细胞比例与对照组比较明显增加外, Annexin V和PI同时着染的死亡细胞比例也显著增加, 其中存在两种可能性: (1)体外试验体系中缺乏体内存在的巨噬细胞吞噬系统, 所以凋亡细胞的胞膜完整性随时间延长而逐渐丧失, 因而被PI着染; (2)三种药物除了可引起细胞凋亡外, 还有可能直接引起细胞坏死. 根据不同时间凋亡和死亡细胞比例的变化看, 24 h时各组即有一定比例的死亡细胞出现, 凋亡细胞与死亡细胞比例随药物作用时间延长而同时增加, 缺乏明显的随时间延长凋亡细胞比例下降、死亡细胞比例增加的演变趋势. 同时, 荧光显微镜及电镜观察结果也证实, 各药物处理组既有Hoechst33258强染、染色质明显浓集的凋亡细胞存在, 又有PI着染、胞质胞核高度肿胀的死亡细胞存在. 因此, 我们认为三种药物及其配伍对MC细胞有明显的毒性作用, 其作用机制部分通过诱导凋亡途径实现, 部分则通过直接引起细胞坏死实现.
编辑: 潘伯荣 审读:张海宁
| 1. | Shi XY, Zhao FZ, Dai X, Ma LS, Dong XY, Fang J. Effect of jianpiyiwei capsule on gastric precancerous lesions in rats. World J Gastroenterol. 2002;8:608-612. [PubMed] [DOI] |
| 2. | 王 文, 夏 天, 张 仲海, 王 宗仁, 张 金洲, 李 锋, 李 军昌, 行 利. 益胃冲剂对胃癌前病变大鼠黏膜上皮细胞DNA 量及AgNOR数的影响. 第四军医大学学报. 2003;24:409-411. |
| 3. | 张 运贵, 孙 兆田, 姚 桂芹, 韩 莉, 薛 强. 胃复春治疗胃黏膜异型增生临床观察及对p21ras和p53表达的调节作用. 中国中西医结合消化杂志. 2004;12:95-97. |
| 7. | Amanuma K, Nakamura T, Aoki Y. MNNG-induced mutations in the adult gill and hepatopancreas and in embryos ofrpsL transgenic zebrafish. Mutat Res. 2004;556:151-161. [PubMed] [DOI] |
| 8. | di Pietro M, Marra G, Cejka P, Stojic L, Menigatti M, Cattaruzza MS, Jiricny J. Mismatch repair-dependenttranscriptome changes in human cells treated with the methylating agent N-methyl-n-nitro-N- nitrosoguanidine. Cancer Res. 2003;63:8158-8166. [PubMed] |
| 9. | Corso C, Parry JM. Comparative genomic hybridization analysis of N-methyl-N-nitrosoguanidine-induced ratgastrointestinal tumors discloses a cytogenetic fingerprint. Environ Mol Mutagen. 2004;43:20-27. [PubMed] [DOI] |
| 10. | Yamashita S, Nomoto T, Abe M, Tatematsu M, Sugimura T, Ushijima T. Persistence of gene expression changesin stomach mucosae induced by short-term N-methyl-N-nitro-N-nitrosoguanidine treatment and their presence instomach cancers. Mutat Res. 2004;549:185-193. [PubMed] [DOI] |
| 11. | Yi ZC, Zhang M, Fu JL, Wang Z, Zhou ZC. Down-regulation of mitotic checkpoint in transformed human embryolung fibroblasts induced by N-methyl-N-nitro-N-nitrosoguaridine. Chin Med J (Engl). 2004;117:1079-1083. [PubMed] |
| 12. | 苏 秀兰, 柯 杨, 舍 英, 宁 涛, 王 冰, 陆 桂荣, 冯 丽雅, 刘 伟莉. 亚硝胺类化合物MNNG诱导人胃黏膜上皮细胞系 GES-1恶性转化的研究. 内蒙古医学杂志. 1995;15:65-67. |
| 14. | Wozniak D, Lamer-Zarawska E, Matkowski A. Antimutagenic and antiradical properties of flavones from the roots ofScutellaria baicalensis georgi. Nahrung. 2004;48:9-12. [PubMed] [DOI] |
| 15. | Chen X, Nishida H, Konishi T. Baicalin promoted the repair of DNA single strand breakage caused by H2O2 in culturedNIH3T3 fibroblasts. Biol Pharm Bull. 2003;26:282-284. [PubMed] [DOI] |
| 16. | Miocinovic R, McCabe NP, Keck RW, Jankun J, Hampton JA, Selman SH. In vivo and in vitro effect of baicalein onhuman prostate cancer cells. Int J Oncol. 2005;26:241-246. [PubMed] |
| 17. | Franek KJ, Zhou Z, Zhang WD, Chen WY. In vitro studies of baicalin alone or in combination with Salvia miltiorrhizaextract as a potential anti-cancer agent. Int J Oncol. 2005;26:217-224. [PubMed] |
| 18. | Ciesielska E, Gwardys A, Metodiewa D. Anticancer, antiradical and antioxidative actions of novel Antoksyd S and itsmajor components, baicalin and baicalein. Anticancer Res. 2002;22:2885-2891. [PubMed] |
| 19. | Chen S, Ruan Q, Bedner E, Deptala A, Wang X, Hsieh TC, Traganos F, Darzynkiewicz Z. Effects of the flavonoid baicalinand its metabolite baicalein on androgen receptor expression, cell cycle progression and apoptosis of prostate cancercell lines. Cell Prolif. 2001;34:293-304. [PubMed] [DOI] |
| 20. | Chan FL, Choi HL, Chen ZY, Chan PS, Huang Y. Induction of apoptosis in prostate cancer cell lines by a flavonoid,baicalin. Cancer Lett. 2000;160:219-228. [PubMed] [DOI] |
| 21. | Ueda S, Nakamura H, Masutani H, Sasada T, Takabayashi A, Yamaoka Y, Yodoi J. Baicalin induces apoptosis viamitochondrial pathway as prooxidant. Mol Immunol. 2002;38:781-791. [PubMed] [DOI] |
| 22. | Chou CC, Pan SL, Teng CM, Guh JH. Pharmacoligical evaluation of several major ingredients of Chinese herbalmedicines in human hepatoma Hep3B cells. Eur J Pharm Sci. 2003;19:403-412. [PubMed] [DOI] |
| 24. | Liu WK, Xu SX, Che CT. Anti-proliferative effect of gingseng saponins on human prostate cancer cell line. Life Sci. 2000;67:1297-1306. [PubMed] [DOI] |
| 25. | Kim HS, Lee EH, Ko SR, Choi KJ, Park JH, Im DS. Effects of ginsenosides Rg3 and Rh2 on the proliferation ofprostate cancer cells. Arch Pharm Res. 2004;27:429-435. [PubMed] [DOI] |
| 27. | Vermes I, Haanen C, Steffens-Nakken H, Reutelingsperger C. A novel assay for apoptosis: flow cytometric detectionof phosphatidylserine expression on early apoptosis cells using fluorescein labeled annexin V. J Immunol Methods. 1995;184:39-51. [PubMed] [DOI] |
| 28. | Plenchette S, Filomenko R, Logette E, Solier S, Buron N, Cathelin S, Solary E. Analyzing markers of apoptosis in vitro. Methods Mol Biol. 2004;281:313-331. [PubMed] [DOI] |
| 29. | Fan X, Krahling S, Smith D, Williamson P, Schlegel RA. Macrophage surface expression of annexins I and II in thephagocytosis of apoptotic lymphocytes. Mol Biol Cell. 2004;15:2863-2872. [PubMed] [DOI] |
| 30. | Borisenko GG, Matsura T, Liu SX, Tyurin VA, Jianfei J, Serinkan FB, Kagan VE. Macrophage recognition of externalizedphosphatidylserine and phagocytosis of apoptotic Jurkat cells-existence of a threshold. Arch Biochem Biophys. 2003;413:41-52. [PubMed] [DOI] |