修回日期: 2002-12-20
接受日期: 2002-12-26
在线出版日期: 2003-08-15
探讨肥大细胞在胃嗜酸性肉芽肿发病中的作用.
应用免疫组化SP染色检测胃嗜酸性肉芽肿中的肥大细胞及微血管密度; HE染色计数嗜酸细胞; 电镜观察肥大细胞脱颗粒情况.
肥大细胞数量在胃溃疡和胃嗜酸性肉芽肿中差别无显著性(9.1±3.0 vs 8.9 ±3.0, P>0.05); 脱颗粒肥大细胞数量及比例在胃嗜酸性肉芽肿组明显高于胃溃疡组(7.3 ±2.4 vs 4.3±1.4、80.3±15.7% vs 48.4±15.7%, P<0.01); 肥大细胞高计数组微血管密度高于肥大细胞低计数组(57.3±10.7 vs 32.4±7.2, P<0.01); 脱颗粒肥大细胞与嗜酸细胞具有正相关性(r = 0.931, P<0.01).
肥大细胞在胃嗜酸性肉芽肿中可促进嗜酸细胞浸润及血管新生, 可能在胃嗜酸性肉芽肿发病中起重要的作用.
引文著录: 高振军, 罗和生, 操寄望, 余保平, 宋刘来. 肥大细胞在胃嗜酸性肉芽肿发病中的作用. 世界华人消化杂志 2003; 11(8): 1203-1206
Revised: December 20, 2002
Accepted: December 26, 2002
Published online: August 15, 2003
To investigate the function of mast cells in the pathogenesis of gastric eosinophilic granuloma.
Paraffin embedded tissue sections from 23 gastric eosinophilic granuloma patients and 15 gastric ulcer patients were stained with anti-human mast cell tryptase to count the mast cells and degranulated mast cells. Anti-human CD34 antibody was used to detect the mocrovessel density with immunohistochemical technique. Mast cell degranulation was also studied by electron microscope.
The quantity of mast cells in gastric eosinophilic granuloma was similar to that in gastric ulcer(9.1±3.0 vs 8.9±3.0, P>0.05). The quantity and ratio of degranulated mast cells were significantly greater in gastric eosinophilic granuloma patients than in gastric ulcer control subjects(7.3±2.4 vs 4.3±1.4, 80.3±15.7% vs 48.4±15.7%, P<0.01). Microvessel density was higher in the patients of high mast cell count than in patients of low mast cell count (57.3±10.7 vs 32.4±7.2, P<0.01). There was a positive relevance between the amount of mast cells and eosinophils (r = 0.931, P<0.01).
Mast cells are important cells in the pathogenesis of gastric eosinophilic granuloma.
- Citation: Gao ZJ, Luo HS, Cao JW, Yu BP, Song LL. Effect of mast cell in pathogenesis of gastric eosinophilic granuloma. Shijie Huaren Xiaohua Zazhi 2003; 11(8): 1203-1206
- URL: https://www.wjgnet.com/1009-3079/full/v11/i8/1203.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i8.1203
胃嗜酸性肉芽肿(gastric eosinophilic granuloma, GEG)是一种以胃黏膜下层及肌层大量嗜酸细胞浸润为特征的良性病变. 由Kaizsen于1937年首次报道, 临床少见, 但近年来报道逐渐增多. 临床易误诊为胃癌或胃溃疡(gastric ulcer, GU), 其病因及发病机制目前尚不清楚. 肥大细胞(mast cell, MC)是变态反应和炎性反应中的关键效应细胞, 也是重要的调节细胞[1-4]. 嗜酸细胞是GEG的特征性细胞, 大量的小血管增生是胃嗜酸性肉芽肿的重要特点[5]. 通过MC与嗜酸细胞及微血管密度(microvessel density, MVD)的关系探讨MC在GEG发病中的作用.
选取武汉大学人民医院1997-2001年手术及术后病理确诊的GEG之蜡块标本共23例, 男20例, 女3例, 年龄19-64岁(平均39.2岁). 电镜标本为2001-09我院门诊电子胃镜深挖活检GEG组织(为半月前病理确诊此次复查病例), 随机取同期GU手术切除标本15例作为对照组. 鼠抗人肥大细胞类胰酶抗体(AA1)标记MC, 鼠抗人CD34抗体标记血管内皮细胞, 免疫组化SP检测试剂盒, DAB显色试剂盒均购自福州迈新生物技术有限公司.
每例标本连续切取4 μm厚组织切片3片, 一片作HE染色, 其余两片做免疫组化染色. 免疫组化SP染色MC类胰酶染色经10 g/L胰蛋白酶消化, 抗CD34染色经微波抗原修复, 阴性对照采用PBS缓冲液做一抗, 其余步骤严格按SP染色试剂盒说明书进行 所有细胞计数均由两名病理科医生在双盲下完成. 抗MC类胰酶染色为胞质着色, 阳性者胞质为棕黄色或棕褐色, 细胞呈圆形或类圆形、胞膜完整者视为未脱颗粒MC, 细胞形态不规则, 胞膜不完整或周围组织有棕黄色颗粒者视为脱颗粒MC. 在MC集中区域随机取5个高倍镜视野计数, 平均值为该标本的MC数(/×400). 抗CD34抗体阳性为胞质或胞膜染成棕黄色或棕褐色. GEG的MVD检测标准参照肿瘤MVD的标准[6], 抗CD34抗体免疫组化染色阳性的与比邻微血管、细胞及其他结缔组织不相连的任何内皮细胞均作为一条独立的微血管, 每一标本在低倍镜(×100)下选3个微血管最多的区域, 在每一个区域中计数一个高倍视野(×400)下的微血管数, 取3个视野的均值即为MVD, 有平滑肌包绕的大血管除外. 电镜标本送武汉大学医学院电镜室, 在胃镜下于病变处深挖活检取材, 迅速浸入25 g/L戊二醛固定, 再经锇酸后固定, 梯度酒精脱水, 丙酮脱水, 环氧树脂包埋, LKB-V型超薄切片机切片, 醋酸双氧铀、枸橼酸铅染色, 干燥后在日立-600型透射电镜下观察. 石蜡切片脱蜡至水, 冲洗后, 苏木精室温染色5 min, 自来水洗, 10 ml/L盐酸酒精分色, 冲洗后, 伊红室温下染色5 min, 水洗、脱水、透明, 中性树胶封片, 光镜下观察, 嗜酸细胞呈圆形, 胞质红色, 胞核蓝色, 一般为双核. 在黏膜下层嗜酸细胞集中区域选取5个视野, 高倍镜(×400)下计数, 取平均值即为该标本的嗜酸细胞数(/×400).
统计学处理 数据用均数±标准差表示. 样本之间比较采取t检验或χ2检验, 以P<0.05为差别有显著性, 相关性分析采用Spearman相关.
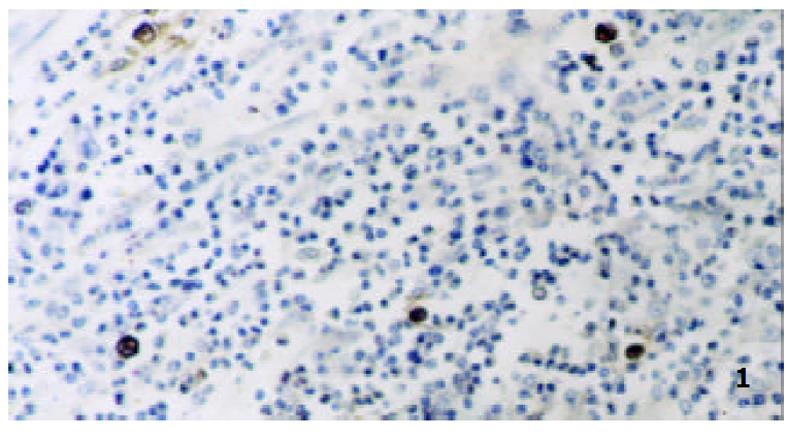
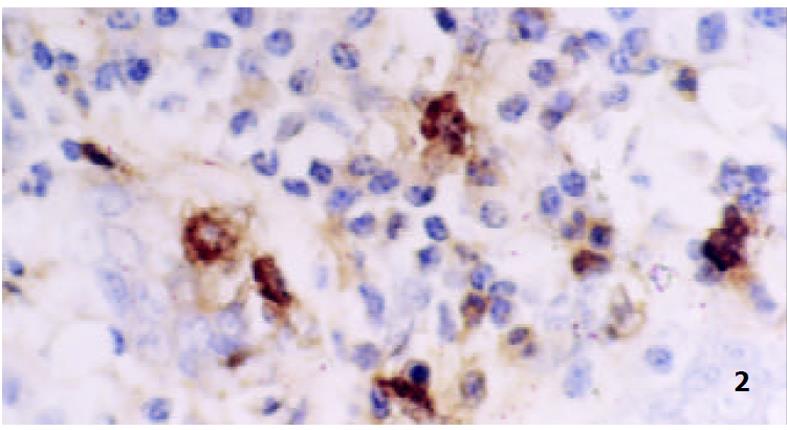
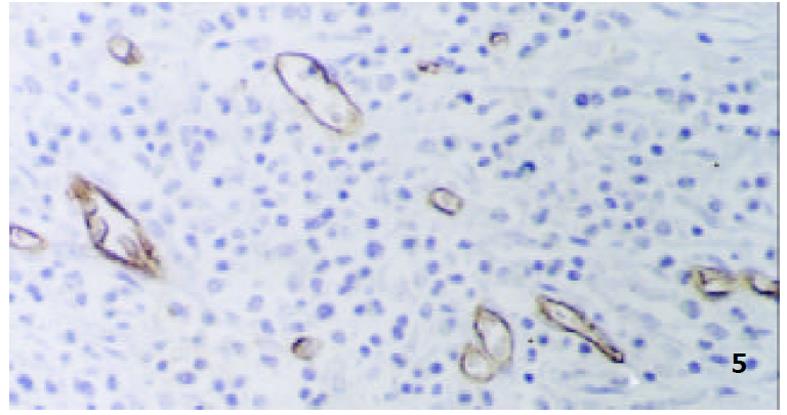
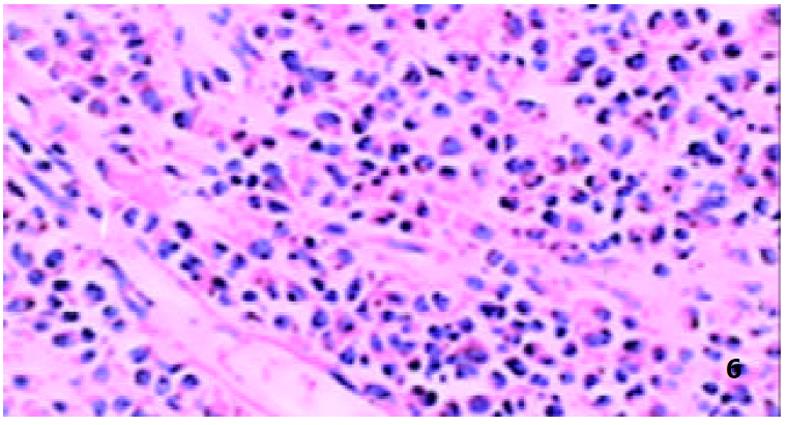
GEG组织中MC多位于黏膜下层、肌层和小血管周围, MC计数(/×400)为9.1±3.0, 脱颗粒MC数(/×400) 为7.3 ±2.4, 脱颗粒比为80.3± 15.7%; GU组织中MC多位于黏膜固有层及黏膜下层, MC计数(/×400)为8.9±3.0, 脱颗粒MC数(/×400)为4.3 ±1.4, 脱颗粒比为48.4± 15.7%. 二者之间比较: MC计数之间差别无显著性(P>0.05), 脱颗粒MC计数二者之间比较差别有显著性(P<0.01), 脱颗粒细胞比例之间比较差别有显著性(P<0.05), (图1, 图2).
按MC计数的均数为标准把GEG组分为高计数组(MC≥9.07)13例和低计数组(MC<9.07)10例, MC高计数组MVD(/×400)为57.3±10.7, MC低计数组MVD为32.4±7.2. 两组之间比较差别有显著性(P<0.01, 图5).
GEG发病以男性青壮年为主, 在病理组织学上一般有溃疡形成, 黏膜下和肌层有大量嗜酸细胞、淋巴细胞浸润, 肉芽组织中有纤维组织围绕血管增生, 可见纤维瘢痕和玻璃样变, 小动脉、小静脉和淋巴管大量增生, 肌层被嗜酸细胞分割挤压, 甚至浆膜层亦有大量嗜酸细胞浸润. GEG的病因有过敏反应学说, 炎症学说, 异物反应学说和家族遗传学说等推测, 但目前多数学者认为是胃组织对局部炎性刺激物产生的一种特殊反应和过敏反应[5]. MC由造血干细胞衍化而来, 是变态反应和炎性反应中的关键效应细胞, 也是重要的调节细胞. 其表面表达有与IgE抗体Fc段高度亲和力的受体(FcεRI), 当MC受抗原结合的IgE抗体刺激会出现脱颗粒效应, 释放嗜酸性粒细胞趋化因子(ECAF)、组胺、肝素、蛋白酶等, MC脱颗粒后会分泌前列腺素D2, 白三烯C4, D4, E4, 血小板活化因子(PAF), IL-4, 5, 6, 8等[7]. MC不仅可通过释放炎性递质和血管活性递质引起机体重要的病理生理变化, 还可通过TNF-α及其他一些细胞因子趋化其他炎症细胞[8-10], 从而引起炎症的级联放大和持续过程.
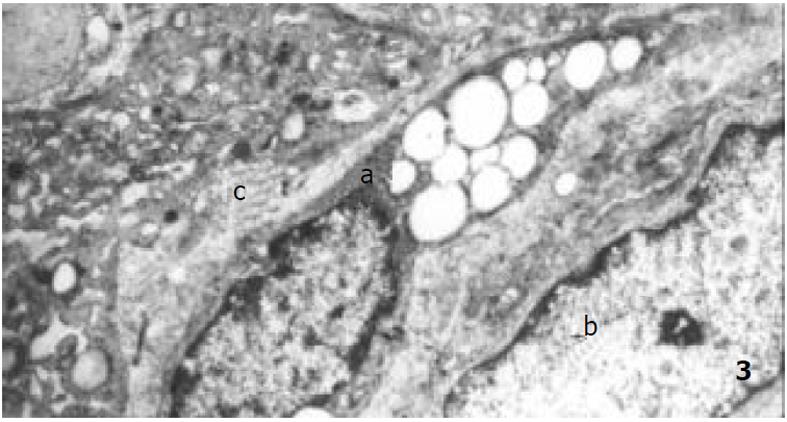
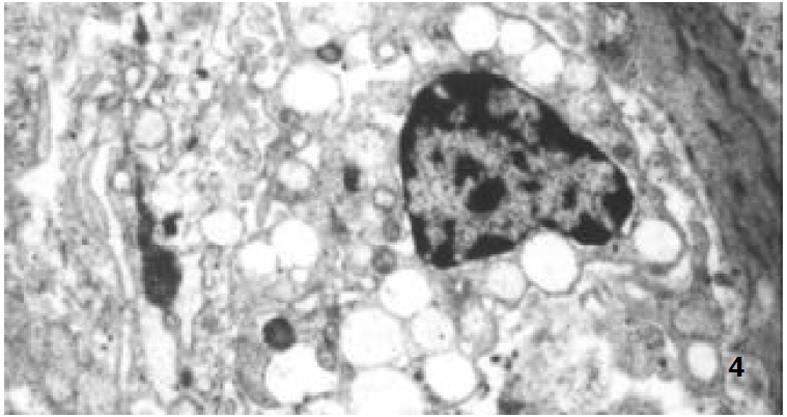
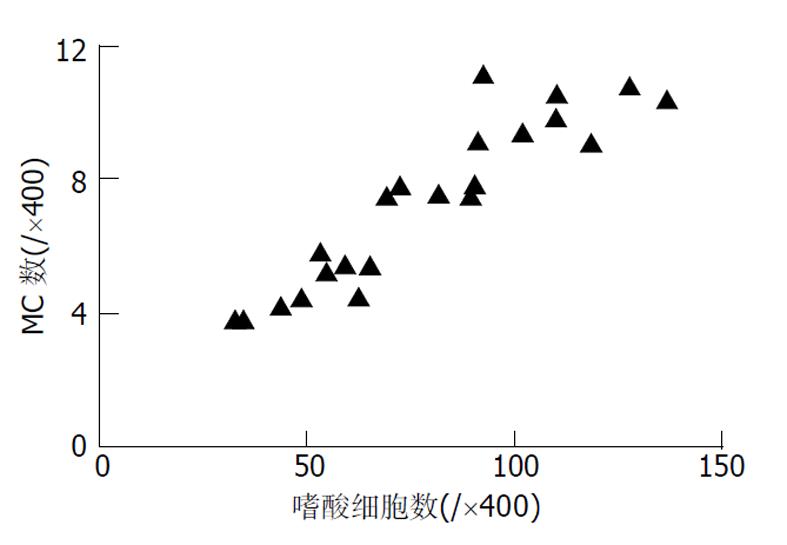
正常人群胃壁中有MC存在, GU与慢性活动性胃炎MC数量明显增多[7,11,12]. MC参与炎症的早期反应, 其在胃壁中的数量由趋化物质决定, 包括干细胞因子、IL-3、转化生长因子β1等, 在炎性启动机制基础上由成纤维细胞、内皮细胞、淋巴细胞或巨噬细胞释放[13,14]. 我们发现, MC数量在GEG和GU中差别无显著性, 可能MC的增多在GEG中与在GU中具有相似的炎性启动机制. 能引起MC脱颗粒的物质主要有IgE、补体片断、细胞因子等[9,15]. GEG中脱颗粒MC数量及比例均明显增多, 意味着在MC增多的基础上又有其他能使MC脱颗粒的因素介入. 在电镜检查中可观察到肥大细胞脱颗粒现象, 因GEG电镜标本搜集困难, 未与GU作对比研究, 但可证实GEG中MC确有脱颗粒现象. Nakajima et al [7]已用电镜证实在无症状志愿人员中极少有脱颗粒现象. 由此推测, MC数量及脱颗粒增加, 可能与GEG的特殊病理表现有关.
新生血管在肿瘤、炎症的病情进展中起重要作用[6,16-29], GEG在病理组织学上有大量的小血管存在, MVD是新生血管的标志[6,27-30]. 在本研究中发现, MC与MVD聚集区域一致, MC高计数组MVD明显增加, 提示, MC与GEG中的血管形成有关, 在一些实验中已证实MC与血管新生有关[6,17,18]. MC可引起VEGF, bFGF, TGF-β, TNF-α 和IL-8等促血管生成因子的产生[17,18,31], MC颗粒中的组胺、肝素等具有促血管生成的作用, 能够趋化和激活单核巨噬细胞、淋巴细胞, 激活血小板进一步促进血管生成因子的释放. 血管新生与大量的炎性细胞浸润有关, 在GEG中也有可能与嗜酸细胞的浸润有关, 尚待进一步证实.
嗜酸细胞是GEG的特征性细胞, 他是特异反应的标志, 也是重要的效应细胞.嗜酸细胞可产生独特的损害性的炎性递质[32], 嗜酸细胞在病变中的浸润由趋化物质决定, 主要由MC和淋巴细胞释放. 在胃部炎性病变中, MC密度与单核和多核炎性细胞浸润的数量密切相关[7]. MC参与炎症的急性过程, 并且参与慢性炎症的持续过程, MC浸润出现在嗜酸细胞之前[33], 我们发现, 脱颗粒MC数量与病变中嗜酸细胞数量有明显的正相关性, 提示在GEG中MC与嗜酸细胞的浸润有关, 其机制可能是: (1)MC脱颗粒时会释放ECA-F, 白三烯, IL-5等, 这些因子对嗜酸性粒细胞均有趋化作用[7]; (2)MC产生的TNF-α能够促进淋巴细胞的浸润[8], 而Th2淋巴细胞会产生IL-4, IL-5等细胞因子[34], 他们都是重要的嗜酸细胞趋化因子. MC还可活化嗜酸细胞, 促进其活性递质的释放.
MC可释放重要的炎性递质, 还可影响血管内皮细胞和其他炎性细胞, 通过一系列复杂机制使炎症持续, 肉芽肿形成, 血管生成和组织纤维化[35]. MC, 嗜酸细胞和淋巴细胞都是重要的过敏性和炎性疾病的效应细胞[32], 病变中大量MC、嗜酸细胞和淋巴细胞的存在提示GEG发病可能与过敏性和炎性因素有关, 而MC可能通过促进嗜酸细胞浸润及血管新生而在GEG发病中起重要作用, 并可能是其发病的关键效应细胞.
| 1. | 迟 晶, 傅 宝玉, 九 岛亮治, 中 岛滋美, 服 部隆则. 沙土鼠幽门螺杆菌感染胃炎、胃溃疡动物模型的建立及除菌治疗前后炎症和细胞增生的变化. 世界华人消化杂志. 1999;7:557-560. |
| 3. | Robbie-Ryan M, Brown M. The role of mast cells in allergy and autoimmunity. Curr Opin Immunol. 2002;14:728-733. [DOI] |
| 4. | Kobayashi T, Ohta Y, Inui K, Yoshino J, Nakazawa S. Protective effect of omeprazole against acute gastric mucosal lesions induced by compound 48/80, a mast cell degranulator, in rats. Pharmacol Res. 2002;46:75-84. [DOI] |
| 5. | Yoh H, Natsugoe S, Ohsako T, Yamada K, Suenaga T, Hokita S, Ohi H, Nishimata Y, Nishimata H, Aikou T. Eosinophilic granuloma of the stomach mimicking gastric cancer, report of a case. Hepatogastroenterology. 2001;48:606-608. [PubMed] |
| 6. | Viacava P, Gasperi M, Acerbi G, Manetti L, Cecconi E, Bonadio AG, Naccarato AG, Acerbi F, Parenti G, Lupi I. Microvascular density and vascular endothelial growth factor expression in normal pituitary tissue and pituitary adenomas. J Endocrinol Invest. 2003;26:23-28. [PubMed] [DOI] |
| 7. | Krishnaswamy G, Martin R, Walker E, Li C, Hossler F, Hall K, Chi DS. Moraxella catarrhalis induces mast cell activation and nuclear factor kappaB-dependent cytokine synthesis. Front Biosci. 2003;8:A40-47. [PubMed] [DOI] |
| 8. | Latti S, Leskinen M, Shiota N, Wang Y, Kovanen PT, Lindstedt KA. Mast cell-mediated apoptosis of endothelial cells in vitro: A paracrine mechanism involving TNF-alpha-mediated down-regulation of bcl-2 expression. J Cell Physiol. 2003;195:130-138. [PubMed] [DOI] |
| 9. | Maciorkowska E, Dzieciol J, Kemona A, Kaczmarski M. Evaluation of selected cytokines and mononuclear cell infiltration in gastric mucosa of children with food allergy. Med Sci Monit. 2000;6:567-572. [PubMed] |
| 10. | Wan MX, Wang Y, Liu Q, Schramm R, Thorlacius H. CC chemokines induce P-selectin-dependent neutrophil rolling and recruitment in vivo: intermediary role of mast cells. Br J Pharmacol. 2003;138:698-706. [PubMed] [DOI] |
| 11. | Sulik A, Kemona A, Sulik M, Oldak E. Mast cells in chronic gastritis of children. Pol Merkuriusz Lek. 2001;10:156-160. |
| 12. | Biernacka D, Muszynski J, Tomaszewska A, Moskalewski S. Relationship between mast cells/parietal cells and maximal/basal acid output ratio in chronic gastritis. Res Exp Med (Berl). 2000;200:35-41. |
| 13. | Olsson N, Piek E, Sundstrom M, ten Dijke P, Nilsson G. Transforming growth factor-beta-mediated mast cell migration depends on mitogen-activated protein kinase activity. Cell Signal. 2001;13:483-490. [DOI] |
| 14. | Bamba N, Nakajima S, Andoh A, Bamba M, Sugihara H, Bamba T, Hattori T. Stem cell factor expressed in human gastric mucosa in relation to mast cell increase in Helicobacter pylori-infected gastritis. Dig Dis Sci. 2002;47:274-282. [DOI] |
| 15. | Yamamoto J, Watanabe S, Hirose M, Osada T, Ra C, Sato N. Role of mast cells as a trigger of inflammation in Helicobacter pylori infection. J Physiol Pharmacol. 1999;50:17-23. [PubMed] |
| 16. | Cianchi F, Palomba A, Messerini L, Boddi V, Asirelli G, Perigli G, Bechi P, Taddei A, Pucciani F, Cortesini C. Tumor angiogenesis in lymph node-negative rectal cancer: correlation with clinicopathological parameters and prognosis. Ann Surg Oncol. 2002;9:20-26. [DOI] |
| 17. | Fukushima N, Satoh T, Sano M, Tokunaga O. Angiogenesis and mast cells in non-Hodgkin's lymphoma: a strong correlation in angioimmunoblastic T-cell lymphoma. Leuk Lymphoma. 2001;42:709-720. [PubMed] [DOI] |
| 18. | Ranieri G, Labriola A, Achille G, Florio G, Zito AF, Grammatica L, Paradiso A. Microvessel density, mast cell density and thymidine phosphorylase expression in oral squamous carcinoma. Int J Oncol. 2002;21:1317-1323. [DOI] |
| 24. | 曹 玮, 王 执民, 梁 志会, 张 洪新, 王 义清, 关 彦, 李 文献, 潘 伯荣. 血管生成抑制剂TNP-70与碘化油混合栓塞肝癌的实验研究. 世界华人消化杂志. 2000;8:629-632. |
| 29. | Kim HK, Song KS, Park YS, Kang YH, Lee YJ, Lee KR, Kim HK, Ryu KW, Bae JM, Kim S. Elevated levels of circulating platelet microparticles, VEGF, IL-6 and RANTES in patients with gastric cancer: possible role of a metastasis predictor. Eur J Cancer. 2003;39:184-191. [DOI] |
| 30. | Pruneri G, Ponzoni M, Ferreri AJ, Decarli N, Tresoldi M, Raggi F, Baldessari C, Freschi M, Baldini L, Goldaniga M. Microvessel density, a surrogate marker of angiogenesis, is significantly related to survival in multiple myeloma patients. Br J Haematol. 2002;118:817-820. [DOI] |
| 31. | Artuc M, Steckelings UM, Henz BM. Mast cell-fibroblast interactions: human mast cells as source and inducers of fibroblast and epithelial growth factors. J Invest Dermatol. 2002;118:391-395. [PubMed] [DOI] |
| 32. | Park HS, Kim SS, Kim HA, Suh YJ, Lee SK, Nahm DH, Lee YM. Eosinophil inflammation of nasal polyp tissue: relationships with matrix metalloproteinases, tissue inhibitor of metalloproteinase-1, and transforming growth factor-beta1. J Korean Med Sci. 2003;18:97-102. [PubMed] [DOI] |
| 33. | Temkin V, Kantor B, Weg V, Hartman ML, Levi-Schaffer F. Tryptase activates the mitogen-activated protein kinase/activator protein-1 pathway in human peripheral blood eosinophils, causing cytokine production and release. J Immunol. 2002;169:2662-2669. [DOI] |